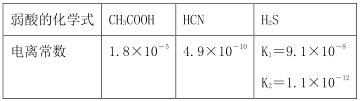
题目内容
【题目】下列粒子半径比较中,正确的是( )
A. Na+<Mg2+<Al3+<K+B. S2->Cl->K+>Ca2+
C. O2->S2->Cl->Br-D. F->Li+>Na+>S2-
【答案】B
【解析】
A.电子层结构相同,核电荷数越大,离子半径越小,离子半径:Al3+<Mg2+<Na+,故A错误;
B.电子层结构相同,核电荷数越大,离子半径越小,电子层数越多,离子半径越大,离子半径:S2->Cl->K+>Ca2+,故B正确;
C.电子层数越多,离子半径越大,离子半径:Br->Cl-,故C错误;
D.电子层数越多,离子半径越大,离子半径:Na+>Li+,故D错误;
故选B。

【题目】煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为﹣285.8kJ/mol、﹣283.0kJ/mol和﹣726.5kJ/mol.请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:______________________________.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度/℃ | 250 | 300 | 350 | |
K/L2mol﹣2 | 2.041 | 0.270 | 0.012 |
①该反应的平衡常数的表达式是____________,由表中数据判断△H__0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为______,则反应速率v(H2)=_______.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的![]() ,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)._______.
,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)._______.

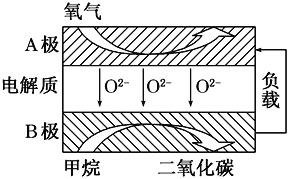
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式__________________.