题目内容
【题目】已知NO2和N2O4可以相互转化:![]()
![]() 。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。
。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。

(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。下列不能说明该反应已达到平衡状态的是________。
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均分子量不随时间变化而改变
(2)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是____________________________________ (用文字表达);
(3)若要准确测定NO2相对分子质量,应采取的有效措施是_________ (填字母序号)
A.升高温度,降低压强 B.降低温度,升高压强
C.降低温度,降低压强 D.升高温度,升高压强
(4)根据图像,计算反应![]() 在该温度下的平衡常数K=________
在该温度下的平衡常数K=________
(5)现用3.2gCu与足量的浓HNO3反应,制得1.68 L N2O4和NO2的混合气体(体积以标况折算),则含有NO2的物质的量为____ ,化学反应__________ (填向逆方向进行、向正方向进行、已达平衡)(温度不变)。
【答案】X b和d B 增大NO2的浓度 A 1.1或![]() 0.05mol 向逆方向进行
0.05mol 向逆方向进行
【解析】
(1)由图可知010min时,X表示的生成物的浓度变化量为(0.60.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.60.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;
由图可知,1025min及30min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,故b、d处于化学平衡状态;
A、恒温恒容容器中,气体压强之比等于气体物质的量之比,当容器内压强不变时,即气体的物质的量不变,该反应属于气体非等体积反应,因此当容器内混合气体的压强不随时间变化而改变时,反应达到平衡状态,故A不选;
B、容器内混合气体的体积不变,质量不变所以密度不变,因此,密度不能判断平衡,故B选;
C、容器内混合气体的颜色不随时间变化而改变,即NO2浓度不再变化,即该反应达到平衡状态,故C不选;
D、该反应属于气体非等体积反应,未达到平衡状态时,气体的物质的量会变化,气体总质量一定,其平均分子量不变时,即气体物质的量不变,可判断该反应达到平衡状态,故D不选;
(2)由曲线看出25min时,NO2的浓度突然增大,可知改变的条件为增大NO2的浓度;
(3)若要准确测定NO2相对分子质量,即体系中NO2百分含量越高越准确,即需要改变外界条件使平衡逆向移动,该反应正向为放热反应,升温可使平衡逆向移动,该反应正向为气体体积减小的反应,减小压强,平衡逆向移动,综上所述,可采取措施为:升高温度,降低压强,答案为A;
(4)以10~25min内各物质平衡浓度计算平衡常数,根据图像可知,c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L,由此计算K=![]() ;
;
(5)3.2gCu Cu与足量的浓HNO3反应,铜完全反应生成Cu(NO3)2,转移电子的物质的量![]() ×2=0.1mol,HNO3作氧化剂的部分生成NO2、N2O4,N元素化合价降低1,设n(NO2)=xmol、n(N2O4)=ymol,根据得失电子守恒,可列出方程组:
×2=0.1mol,HNO3作氧化剂的部分生成NO2、N2O4,N元素化合价降低1,设n(NO2)=xmol、n(N2O4)=ymol,根据得失电子守恒,可列出方程组:
![]() ,解得
,解得![]() ,即含有NO2的物质的量为0.05mol;浓度熵QC=
,即含有NO2的物质的量为0.05mol;浓度熵QC=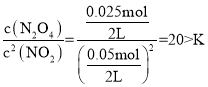 ,则反应向逆方向进行。
,则反应向逆方向进行。

 名校课堂系列答案
名校课堂系列答案