题目内容
下列说法正确的是
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
| A.H2(g)的燃烧热为571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
| C.H2SO4(aq)+Ba(OH)2(aq)==BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)ΔH=+135.9 kJ·mol-1 |
B
解析

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
下列反应既是氧化还原反应,又是吸热反应的是
| A.锌粒与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的碳与CO2反应 | D.葡萄糖在人体内氧化 |
某反应过程中能量变化如下图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
| A.催化剂能降低反应的活化能 |
| B.催化剂能改变反应的焓变(△H) |
| C.该反应为放热反应 |
| D.正反应的活化能小于逆反应的活化能 |
下列变化属于吸热反应的是
①碳与二氧化碳化合
②生石灰与水反应生成熟石灰
③Zn与稀硫酸反应
④氯酸钾分解制氧气
⑤Ba(OH)2.8H2O与NH4Cl反应
⑥甲烷与氧气的燃烧
| A.①④ | B.②③ | C.①④⑤ | D.①②④ |
对于反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
| A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
下列有关说法正确的是
| A.放热反应在任何条件都能自发进行 |
| B.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| D.电解精炼铜时,外电路中转移电子数为2NA个时,阳极铜质量减少64g |
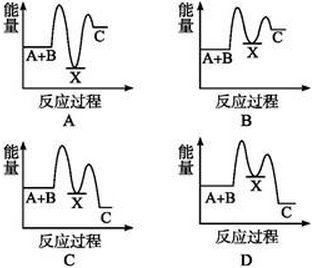
反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1;②X(g)—→C(g) ΔH2。反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是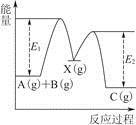
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)—→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
通常人们把拆开1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知
| 化学健 | H-H | Cl-Cl | H-Cl |
| 键能 | 436 kJ·mol-1 | 243 kJ·mol-1 | 431 kJ·mol-1 |
则下列热化学方程式不正确的是( )
A.
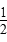 H2(g)+
H2(g)+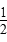 Cl2(g)=HCl(g)ΔH=-91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=-91.5 kJ·mol-1B.H2(g)+Cl2(g)=2HCl(g)ΔH=-183 kJ·mol-1
C.
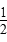 H2(g)+
H2(g)+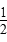 Cl2(g)=HCl(g)ΔH=91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=91.5 kJ·mol-1D.2HCl(g)=H2(g)+Cl2(g)ΔH=183 kJ·mol-1