题目内容
【题目】请按要求填空:
(1)Mg是第3周期元素,该周期部分元素氟化物的熔点见下表:
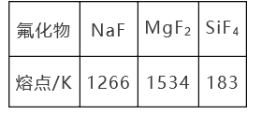
①解释表中氟化物熔点差异的原因:
a._____________________________________________________________________。
b.____________________________________________________________________。
②硅在一定条件下可以与Cl2反应生成SiCl4,试判断SiCl4的沸点比CCl4的________(填“高”或“低”),理由________________________________。
(2)下列物质变化,只与范德华力有关的是_________。
a.干冰熔化 b.乙酸汽化 c.石英熔融 d.HCONHCH2CH3溶于水 e.碘溶于四氯化碳
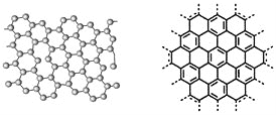
(3)C,N元素形成的新材料具有如下图所示结构,该晶体的化学式为:_____________。

(4)FeCl3常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断FeCl3的晶体类型为_________________。
(5)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大,熔点高、化学性质稳定。
①氮化硅的硬度________(“大于”或“小于”)氮化碳的硬度,原因是________________。
②下列物质熔化时所克服的微粒间的作用力与氮化硅熔化时所克服的微粒间的作用力相同的是_________。
a.单质I2和晶体硅 b.冰和干冰
c.碳化硅和二氧化硅 d.石墨和氧化镁
③已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式________。
(6)第ⅢA,ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。在GaN晶体中,每个Ga原子与______个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________。在四大晶体类型中,GaN属于____晶体。
【答案】 NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高 因为Mg2+的半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MaF2的熔点大于NaF 高 SiCl4的相对分子质量比CCl4的大,范德华力大,因此沸点高 ae C3N4 分子晶体 小于 硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅键长短,键能更大 c Si3N4 4 正四面体 原子
【解析】(1)①氟化物的熔点与晶体类型有关,离子晶体的熔点较高,分子晶体的熔点较低;
②根据影响分子晶体熔沸点高低的因素分析;
(2)分子晶体中分子之间存在范德华力,范德华力与分子晶体的熔沸点、硬度有关,注意范德华力与氢键、化学键的区别;
(3)根据均摊法判断;
(4)根据分子晶体的熔沸点较低判断;
(5)根据影响原子晶体硬度的因素分析;根据晶体类型分析,熔化时原子晶体破坏共价键,分子晶体破坏分子间作用力;根据最外层电子数和每个原子都满足8电子稳定结构判断;
(6)单晶硅是Si正四面体向空间延伸的立体网状结构,为原子晶体,GaN晶体结构与单晶硅相似,GaN属于原子晶体,根据单质硅的晶体结构判断。
(1)①离子晶体的熔点较高,分子晶体的熔点较低,NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高;又因为Mg2+的半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MaF2的熔点大于NaF;
②由于SiCl4与CCl4形成的晶体均是分子晶体,SiCl4的相对分子质量比CCl4的大,范德华力大,因此沸点高;
(2)a.干冰属于分子晶体,熔化时克服范德华力,a正确;b.乙酸分子间含有氢键,乙酸汽化克服氢键和范德华力,b错误;c.石英的主要成分为二氧化硅,属于原子晶体,石英熔融时克服共价键,c错误;d.HCONHCH2CH3溶于水时克服氢键和范德华力,d错误;e.碘属于分子晶体,溶于四氯化碳只克服范德华力,e正确;答案选ae;
(3)根据晶胞结构可知含有的碳原子个数是8×1/8+4×1/2=3,氮原子全部在晶胞中,含有的氮原子个数是4,则该晶体的化学式为C3N4。
(4)FeCl3常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂,由此判断FeCl3的晶体类型为分子晶体;
(5)①氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大,熔点高、化学性质稳定,这说明二者形成的晶体是原子晶体,由于硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅键长短,键能更大,所以氮化硅的硬度小于氮化碳的硬度。
②根据晶体类型分析,熔化时原子晶体破坏共价键,分子晶体破坏分子间作用力,a.单质I2属于分子晶体,克服分子间作用力,晶体硅属于原子晶体克服共价键;b.冰和干冰都是分子晶体,克服分子间作用力;c.碳化硅和二氧化硅都是原子晶体,克服共价键;d.石墨和氧化镁分别是原子晶体、离子晶体,分别克服共价键、离子键,答案选c;
③N最外层电子数为5,要满足8电子稳定结构,需要形成3个共价键,Si最外层电子数为4,要满足8电子稳定结构,需要形成4个共价键,所以氮化硅的化学式为Si3N4;
(6)GaN晶体结构与单晶硅相似,GaN属于原子晶体,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为正四面体。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案