��Ŀ����
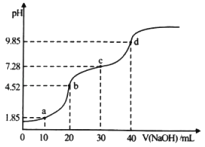
����Ŀ���ڱ�״���£���224LHCl�����ܽ���635mLˮ�У�����������ܶ�Ϊ��1.18gcm��3���Լ��㣺
(1)����������������������ʵ���Ũ���Ƕ��٣�___��___
(2)ȡ����������100mL��ϡ����1.18L��������ϡ��������ʵ���Ũ�ȡ�___
(3)����������Na2CO3��NaOH��Ʒ2.53g������50.0mL2.00molL��1�������У���ַ�Ӧ�����ɱ�״���¶�����̼����112mL����Һ���ԣ��кͶ����������ȥ40.0mL1.00molL��1��NaOH��Һ�������кͺ����Һ�����յõ����ٿ˹��壿___
���𰸡�36.5% 11.8mol/L 1molL��1 5.85��
��������
(1)����n=![]() ����HCl���ʵ���������m=nM����HCl����������m=��V����ˮ������������������Һ��������������c=
����HCl���ʵ���������m=nM����HCl����������m=��V����ˮ������������������Һ��������������c=![]() ������Һ���ʵ���Ũ�ȣ�
������Һ���ʵ���Ũ�ȣ�
(2)����ϡ�Ͷ���c(Ũ)V(Ũ)=c(ϡ)V(ϡ)���㣻
(3)������Ӧ�������кͺ����Һ��������ù���ΪNaCl������ClԪ���غ㣺n(NaCl)=n(HCl)���ٸ���m=nM���㡣
(1)n(HCl)=![]() =10mol�� m(HCl)=10mol��36.5gmol1=365g��635mLˮ������Ϊ635mL��1g/mL=635g���������������
=10mol�� m(HCl)=10mol��36.5gmol1=365g��635mLˮ������Ϊ635mL��1g/mL=635g���������������![]() =
=![]() ��100%=36.5%��c(HCl)=
��100%=36.5%��c(HCl)= ![]() =
=![]() =11.8mol/L�������������������Ϊ36.5%�����ʵ���Ũ����11.8mol/L���𰸣�36.5% 11.8mol/L��
=11.8mol/L�������������������Ϊ36.5%�����ʵ���Ũ����11.8mol/L���𰸣�36.5% 11.8mol/L��
(2)����c(Ũ)V(Ũ)=c(ϡ)V(ϡ)����֪c(ϡ)=11.8molL1��0.1L��1.18L=1molL1��
����ϡ��������ʵ���Ũ��1molL1���𰸣�1molL1��
(3)������Ӧ�������кͺ����Һ��������ù���ΪNaCl������ClԪ���غ㣺n(NaCl)=n(HCl)=0.050L��2molL1=0.1mol��m(NaCl)=0.1mol��58.5gmol1=5.85g�����յõ�����5.85g�����Դ𰸣�5.85g��

����Ŀ���Ȼ���ͭ��CuCl)�㷺Ӧ���ڻ�����ӡȾ����Ƶ���ҵ��CuCl�����ڴ���ˮ��������������Ũ�Ƚϴ����ϵ���ڳ�ʪ��������ˮ���������Ժ���ͭ����Ҫ�ɷ���Cu������CuO��Ϊԭ�ϣ���������������ֽ⼼������CuCl�Ĺ��չ������£�
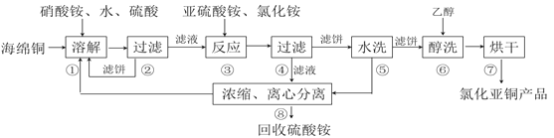
�ش��������⣺
��1���������еõ�������������_________���ܽ��¶�Ӧ������60~70�ȣ�ԭ����__________��
��2��д������������Ҫ��Ӧ�����ӷ���ʽ___________��
��3��������������pH=2����ϴ��ˮϴ������������ϴ���õ�����_________��д���ƣ���
��4�����������У�����������ʡ�ԣ�������______________________________��
��5����������������������Ҫ���й�Һ���롣��ҵ�ϳ��õĹ�Һ�����豸��__________������ĸ��
A�������� | B�����Ļ� | C����Ӧ�� | D����ʽѹ�˻� |
��6��ȷ��ȡ���Ʊ����Ȼ���ͭ��Ʒm g����������������FeCl3��Һ�У�����Ʒ��ȫ�ܽ��������ϡ���ᣬ��a mol/L��K2Cr2O7��Һ�ζ����յ㣬����K2Cr2O7��Һb mL����Ӧ��Cr2O72-����ԭΪCr3+����Ʒ��CuCl����������Ϊ__________��