��Ŀ����
1�� ��ͼ��ʾ����ͬ�¶��£��ֱ����������ļ�����������ɱ���������зֱ���������SO2��O2�Ļ�����壬��ʼ�ס������������ȣ���Ӧͬʱ���У������Դﵽƽ��״̬��
��ͼ��ʾ����ͬ�¶��£��ֱ����������ļ�����������ɱ���������зֱ���������SO2��O2�Ļ�����壬��ʼ�ס������������ȣ���Ӧͬʱ���У������Դﵽƽ��״̬����1����ʼʱ���ס��������з�Ӧ���ʴ�С��ϵ��v���ף�=v���ң���
��2����Ӧ���ﵽƽ��ס����ݻ��з�Ӧ���ʴ�С��ϵ��v���ף���v���ң������������еķ�Ӧ�ȴﵽƽ��״̬�����ң�
��3����Ӧ�ﵽƽ��ʱ��SO2ת���ʽϴ�����ң�
��4���ס��������ڷ�Ӧ�ﵽƽ��ֱ����ϡ�����壬�����еĻ�ѧƽ���ƶ����Ϊ��ѡ����ĸ����AD��
A������ƽ�ⲻ�ƶ� B������ƽ�ⲻ�ƶ�
C������ƽ��������Ӧ�����ƶ� D������ƽ�����淴Ӧ�����ƶ���
���� �ɷ���ʽ2SO2+O2?2SO3��֪������ӦΪ�������ʵ�����С�Ŀ��淴Ӧ����ʼʱ���������з�Ӧ��Ũ�ȡ�ѹǿ��ͬ����Ӧ������ͬ���淴Ӧ���У�������������ѹǿ��С���������������С��ѹǿ���䣬���Լ������з�Ӧ�������������������ȴﵽƽ��״̬���ҷ�Ӧ��ת���ʽϴ�Ӧ�ﵽƽ��״̬����������������ϡ�����壬��Ӧ�������������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���ѹǿ����ʱ����ϡ�����壬��Ӧ������������Ũ�ȼ�С��ƽ���������������������ƶ����ݴ˷�����
��� �⣺��1����ʼʱ���������з�Ӧ��Ũ�ȡ�ѹǿ��ͬ����Ӧ������ͬ���ʴ�Ϊ��=��
��2���ɷ���ʽ2SO2+O2?2SO3��֪������ӦΪ�������ʵ�����С�Ŀ��淴Ӧ����ʼʱ���������з�Ӧ��Ũ�ȡ�ѹǿ��ͬ����Ӧ������ͬ���淴Ӧ���У�������������ѹǿ��С���������������С��ѹǿ���䣬���Լ������з�Ӧ�������������������ȴﵽƽ��״̬���ʴ�Ϊ�������ң�
��3������ӦΪ�������ʵ�����С�Ŀ��淴Ӧ��������������ѹǿ��С���������������С��ѹǿ���䣬���Լ������з�Ӧ�������������������ȴﵽƽ��״̬���ҷ�Ӧ��ת���ʽϴʴ�Ϊ���ң�
��4����Ӧ�ﵽƽ��״̬����������������ϡ�����壬��Ӧ�������������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���ѹǿ����ʱ����ϡ�����壬��Ӧ������������Ũ�ȼ�С��ƽ���������������������ƶ����ʴ�Ϊ��AD��
���� ���⿼����Ӱ�컯ѧƽ���ƶ�������-----Ũ�Ⱥ�ѹǿ��ƽ���ƶ���Ӱ�죬��Ŀ�ѶȲ���

| A�� | �������ƹ�����ˮ��Ӧ��2O22-+2H2O�T4OH-+O2�� | |
| B�� | ������[KAl��SO4��2]��Һ����μ���Ba��OH��2��Һ��SO42-ǡ�ó�����ȫ��2Al3++3SO42-+3Ba2++6OH-�T2Al��OH��3��+3BaSO4�� | |
| C�� | ����������ϡ������Һ��Ӧ�ų�NO���壺Fe+4H++NO3-�TFe3++2H2O+NO�� | |
| D�� | �廯������Һ��������ˮ��ϣ�2Fe2++4Br-+3Cl2�T2Fe3++6Cl-+2Br2 |
| A�� | ��������ˮ��Ӧ | B�� | ͨ�����Ը��������Һ�� | ||
| C�� | ��һ��������ͨ������ | D�� | ����ֱ��ȼ |
| A�� | 2H2��g��+O2��g���T2H2O��l����H=-484kJ/mol | B�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=+242kJ/mol | ||
| C�� | 2H2��g��+O2��g���T2H2O��g����H=-484kJ/mol | D�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-484kJ/mol |
��1���߷��ӽṹ��ʽʾ��ͼ��
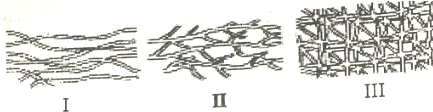
��2���߷��Ӳ��ϵ���Ҫ�����ص㣺
A������������ B���������л��ܼ� C���������л��ܼ� D������ȷ�����۵�
��3����ҪӦ�ã���a�������Ʊ����ϱ�Ĥ ��b�������Ʊ���ѧ���� ��c�� �����Ʊ�������̥
���� | 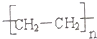 | 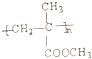 | |
| ��1���ṹ��ʽʾ ��ͼ | |||
| ��2�������ص� | |||
| ��3����ҪӦ�� |
| A�� | ���ۼ������Ȼ�����Һ�У�Fe+2Fe3+�T3Fe2+ | |
| B�� | ����ˮ�ķ�ӦNa+2H2O�TNa++2OH -+H2�� | |
| C�� | ͭƬ������������Һ��Cu+Ag+�TCu2++Ag | |
| D�� | ����ʯ���ڴ���ķ�ӦCaCO3+2H+�TCa2++CO2��+H2O |
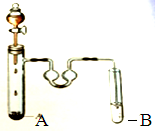 ��ͼ����ȡ�屽��װ�ã��Իش�
��ͼ����ȡ�屽��װ�ã��Իش�