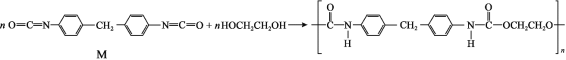
��Ŀ����
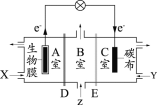
����Ŀ������������ȼ�ϵ��Ϊ��Դ���е���ʵ��װ��ʾ��ͼ��ͼ��ʾ������˵������ȷ���ǣ� ��

A.ȼ�ϵ�ع���ʱ��������ӦΪO2+4H++4e����2H2O
B.a����ͭ��b������ʱ����ʵ�����϶�ͭ
C.a���Ǻ�п�����Ĵ�ͭ��b���Ǵ�ͭ��a���ܽ�ͭ��������b��������ͭ�������
D.��a��b������Ϊʯīʱ������ͬ�����£�a���������������������ĵ�H2�������ͬ
���𰸡�C
��������
���װ��������ȼ�ϵ�أ�������ԭ��أ�ԭ��طŵ�ʱ��ȼ��ʧ���ӷ���������Ӧ������ͨ��H2�ĵ缫Ϊ������ͨ��O2�ĵ缫Ϊ�������������������õ��ӷ�����ԭ��Ӧ�����ڵ������Һ�����ԣ�������ӦΪ��O2+4e-+4H+=2H2O���ұ�װ������ӵ�Դ�������ǵ��أ����Ӹ�����b�缫������������������a�缫�������������Ϸ���ʧ����������Ӧ�������Ϸ����õ��ӻ�ԭ��Ӧ��
A�����ڵ������Һ�����ԣ�����������ԭ��Ӧ����������ԭ����ˮ���缫��ӦΪ��O2+4e-+4H+=2H2O��ѡ��A��ȷ��
B��a����ͭ��b������ʱ��ͭ��������b����ͭ���ӵõ�����ͭ������ѡ��B��ȷ��
C����a���Ǵ�ͭ��b���Ǵ�ͭʱ��a���ϱ�Cu���õĽ���Zn��FeҲʧȥ���ӣ���b����ֻ����Cu�����ݵ����غ㣬��a���ܽ�Cu������С��b��������ͭ��������ѡ��C����ȷ��
D��a��b��������ʯīʱ������ͬ������a������������Ϊ���������ݵ����غ㣬���������ĵ�H2�������ȣ�ѡ��D��ȷ��
��ѡC��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�