题目内容
18.m mol C2H2跟 n mol H2在密闭容器中反应,当该反应(可逆)进行到一定程度时,生成p mol C2H4.将反应后的混合气体完全燃烧,生成CO2和H2O,所需氧气的物质的量是( )| A. | (3m+n)mol | B. | ($\frac{5m}{2}$+$\frac{n}{2}$-3p)mol | C. | ($\frac{5m}{2}$+$\frac{n}{2}$)mol | D. | (3m+n+2p)mol |
分析 无论乙炔和氢气反应程度如何,根据原子守恒,混合物中各元素的原子个数不变,物质的量不变.先计算出碳原子、氢原子的物质的量,然后根据碳氢原子的物质的量求出所需氧气的物质的量.
解答 解:无论乙炔和氢气反应程度如何,根据原子守恒,混合物中各元素的原子个数不变,物质的量不变,则碳氢元素的物质的量分别为:
C2H2~2C~2H
1 2 2
mmol 2mmol 2mmol
H2~2H
1 2
nmol 2nmol
所以混合物中碳原子的物质的量为2mmol,氢原子的物质的量为(2m+2n)mol,
根据碳氢元素完全燃烧可知C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2、2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,
所以混合气体完全燃烧所需氧气为2mmol+$\frac{2m+2n}{4}$mol=$\frac{5m+n}{2}$mol=($\frac{5m}{2}$+$\frac{n}{2}$)mol,
故选C.
点评 本题考查了化合物反应的计算,题目难度不大,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
8.室温下,同种规格的铝片分别与下列物质混合,产生氢气速率最大的是( )
| A. | 0.1 mol/L的盐酸15mL | B. | 0.15 mol/L 的硫酸溶液8mL | ||
| C. | 0.2 mol/L 的盐酸12mL | D. | 18 mol/L的浓硫酸15mL |
9.下列事件处理中,不正确的是( )
| A. | 用福尔马林保存生物标本 | |
| B. | 试管上沾有苯酚时,用水洗 | |
| C. | 实验室不慎将Hg洒在地上时,立即用硫粉覆盖 | |
| D. | 皮肤上沾有苯酚时,立即用酒精擦洗 |
6.下列物质不能通过化合反应直接制得的是( )
| A. | FeCl2 | B. | H2SiO3 | C. | NH4NO3 | D. | HCl |
13.以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
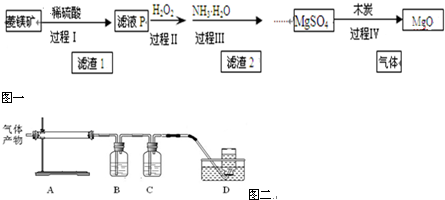
(1)滤液P中含有的阳离子有H+、Fe2+、Mg2+.
(2)过程Ⅱ中发生的氧化还原反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知:
过程Ⅲ中加入NH3•H2O调节溶液pH约为4,其目的是使Fe3+沉淀完全而Mg2+不沉淀.
(4)过程Ⅳ在800℃煅烧MgSO4,发生多个反应,产物除MgO外,还有SO2、CO2、CO、S等气体产物,利用右图装置判断煅烧产生的气体.
①A中试管壁附着有淡黄色固体,该固体的化学式是S.
②B中盛放的溶液是(填字母)d.
a.NaOH 溶液 b.Na2CO3 溶液
c.稀硝酸 d.KMnO4溶液
③写出800℃煅烧MgSO4,产生气体产物是S 和CO的化学方程式MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑.

(1)滤液P中含有的阳离子有H+、Fe2+、Mg2+.
(2)过程Ⅱ中发生的氧化还原反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知:
| Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| 开始沉淀的pH | 10.4 | 1.9 | 7.0 |
| 沉淀完全的pH | 12.4 | 3.2 | 9.0 |
(4)过程Ⅳ在800℃煅烧MgSO4,发生多个反应,产物除MgO外,还有SO2、CO2、CO、S等气体产物,利用右图装置判断煅烧产生的气体.
①A中试管壁附着有淡黄色固体,该固体的化学式是S.
②B中盛放的溶液是(填字母)d.
a.NaOH 溶液 b.Na2CO3 溶液
c.稀硝酸 d.KMnO4溶液
③写出800℃煅烧MgSO4,产生气体产物是S 和CO的化学方程式MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑.
3.同周期的X、Y、Z三种元素,已知其氢化物分别为XH3、H2Y、HZ,则下列判断正确的是( )
| A. | 原子半径 Z>Y>X | |
| B. | Z的非金属性最强 | |
| C. | 氢化物还原性XH3>H2Y>HZ,稳定性XH3>H2Y>HZ | |
| D. | 最高氧化物对应水化物H3XO4酸性最强 |
8.重庆市每天都会发布“空气质量日报”.下列中不列入首要污染物的是( )
| A. | 二氧化硫 | B. | 二氧化碳 | C. | 二氧化氮 | D. | 可吸入颗粒 |
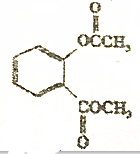 在稀硫酸加热时反应的化学方程式
在稀硫酸加热时反应的化学方程式 +CH3COOH+CH3OH.
+CH3COOH+CH3OH.