题目内容
4. 铝是一种重要的金属.在生产、生活中具有许多重要的用途,图是从铝土矿中制备铝的工艺流程.已知:
铝是一种重要的金属.在生产、生活中具有许多重要的用途,图是从铝土矿中制备铝的工艺流程.已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH
①将硅铝酸盐(Na2Al2Si2O8)沉淀改写成氧化物的形式:Na2O•Al2O3•2SiO2.
②写出向铝土矿中加人足量氢氧化钠溶液后,该步操作中发生的主要反应的离子方程式(除已知条件②外):OH-+Al(OH)3=AlO2-+2H2O;SiO2+2OH-=SiO32-+H2O.
③滤渣A的主要成分为:Fe2O3.
④写出灼烧反应的化学方程式:2Al(OH)3$\frac{\underline{\;高温\;}}{\;}$Al2O3+3H2O.
⑤用双线桥法配平以下化学方程式,并标出电子转移的方向和数目:
10Al+6NaNO3+4Na0H--10NaAlO2+3N2↑+2H2O.
分析 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝,以此解答该题.
解答 解:①硅铝酸盐含有Na、Al、Si、O等元素,写成氧化物的形式为Na2O•Al2O3•2SiO2,故答案为:Na2O•Al2O3•2SiO2;
②氧化铝属于两性氧化物,能和强碱NaOH反应生成偏铝酸钠和水,离子方程式为OH-+Al(OH)3=AlO2-+2H2O,二氧化硅属于酸性氧化物,能和强碱NaOH反应生成硅酸钠和水,离子方程式为SiO2+2OH-=SiO32-+H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O;SiO2+2OH-=SiO32-+H2O;
③由于氧化铁与氢氧化钠溶液不反应,则滤渣A为Fe2O3,故答案为:Fe2O3;
④灼烧时,氢氧化铝分解生成氧化铝,方程式为2Al(OH)3$\frac{\underline{\;高温\;}}{\;}$Al2O3+3H2O,故答案为:2Al(OH)3$\frac{\underline{\;高温\;}}{\;}$Al2O3+3H2O;
⑤Al元素化合价升高,由0价升高到+3价,被氧化,N元素化合价由+5价降低到0价,反应的方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,在反应中失去电子,铝失去电子数为10×3,NaNO3得到电子数为6×5,用“双线桥法”标明反应中电子转移的方向和数目为: ,
,
故答案为:
点评 本题考查混合物的分离和提纯,为高考常见题型,侧重考查学生对物质性质的掌握,明确物质的性质即可解答,熟练注意元素化合物知识,有时还与基本操作、离子检验等联合考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| 操作及现象 | 结论 | |
| A | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和KMnO4溶液,观察气体产生的速度 | 比较CuSO4和KMnO4的催化效果 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色. | 溶液中一定含有Fe2+ |
| C | 测定等浓度的HCOOK和K2S溶液的pH | 比较Ka(HCOOH) 和Ka2(H2S)的大小 |
| D | C2H5OH与浓硫酸混合后加热到170°C,制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸检测:0.1mol•L-1Na2SO3溶液、0.1mol•L-1NaHSO3溶液 | Na2SO3溶液的pH 约为10;NaHSO3 溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半 | 气体颜色比起始时浅 | 加压后,NO2转变为无色的N2O4 |
| D | 饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸 | 沉淀部分溶解且有 气体产生 | Ksp(BaSO4)> Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
| 实验操作 | 实验目的 | |
| A | 将SO2通入紫色石蕊溶液中 | 证明SO2具有漂白性 |
| B | 取两支试管,分别加入4mL0.01mol•L-1KMnO4溶液,然后向一支试管中加0.1mol•L-1H2C2O4溶液2mL,向另一支试管中加入0.1mol•L-1H2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越快 |
| C | 向10mL0.2mol•L-1NaOH溶液中滴入2滴入两滴0.1mol•L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1FeCl2溶液,又生成红褐色沉淀 | 证明在相同温度下的溶度积:Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向含酚酞的Na2SO4溶液中加入BaCl2溶液 | 证明Na2SO4溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  图表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)<Ksp(CuS) | |
| B. |  图表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸 | |
| C. |  图表示用0.l0 mol•L-1NaOH溶液滴定25.00 mL盐酸的滴定曲线,则c(HCl)=0.08mol•L-1 | |
| D. |  图表示反应N2(g)+3H2(g)?2NH3(g)平衡时NH3体积分数随起始$\frac{n({N}_{2})}{n({H}_{2})}$,变化的曲线,则转化率:αA(H2)=αB(H2) |
| A. | 煤的液化 | B. | 石油的分馏 | C. | 石油裂化 | D. | 乙烯加聚反应 |
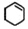 )为原料合成,路线如下(部分反应条件省略):
)为原料合成,路线如下(部分反应条件省略):



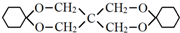 .
. .
.
 ;
; ;
; .
. .
. .
. 和
和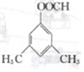 .
. . 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体
. 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体 的合成路线:
的合成路线: .
.
