题目内容
下列说法中正确的是( )
分析:A、溶液中存在水的电离平衡;
B、c(H+)>10-7 mol/L,溶液中氢离子浓度不一定大于氢氧根离子浓度,和溶液温度有关,可能是一定温度下的中性溶液;
C、溶液PH=-lgC(H+),c(H+)越大,则pH值越小;
D、25℃的纯水中存在离子积常数为10-14,纯水电离出的氢离子和氢氧根离子浓度相同;
B、c(H+)>10-7 mol/L,溶液中氢离子浓度不一定大于氢氧根离子浓度,和溶液温度有关,可能是一定温度下的中性溶液;
C、溶液PH=-lgC(H+),c(H+)越大,则pH值越小;
D、25℃的纯水中存在离子积常数为10-14,纯水电离出的氢离子和氢氧根离子浓度相同;
解答:解:A、溶液中存在水的电离平衡,常温下pH值为0的溶液中氢离子浓度为1mol/L,氢氧根离子浓度为10-14,故A错误;
B、c(H+)>10-7 mol/L,溶液中氢离子浓度不一定大于氢氧根离子浓度,和溶液温度有关,可能是一定温度下的中性溶液;故B错误;
C、(H+)越大,则pH值越小,溶液的酸性越强,故C错误;
D、25℃的纯水中存在离子积常数为10-14,纯水电离出的氢离子和氢氧根离子浓度相同,c(H+)=c(OH-)=10-7 mol/L,呈中性,故D正确;
故选D.
B、c(H+)>10-7 mol/L,溶液中氢离子浓度不一定大于氢氧根离子浓度,和溶液温度有关,可能是一定温度下的中性溶液;故B错误;
C、(H+)越大,则pH值越小,溶液的酸性越强,故C错误;
D、25℃的纯水中存在离子积常数为10-14,纯水电离出的氢离子和氢氧根离子浓度相同,c(H+)=c(OH-)=10-7 mol/L,呈中性,故D正确;
故选D.
点评:本题考查了水的电离平衡应用,溶液酸碱性的判断,主要考查溶液中离子积的计算应用,溶液PH的变化判断,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法中正确的是( )
| A、进行钠的有关性质实验时,用剩的钠应放回原试剂瓶 | B、常用25.00 ml 碱式滴定管准确量取20.00 ml KMnO4溶液 | C、用湿润的淀粉碘化钾试纸可以鉴别NO2和Br2蒸气 | D、某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
| A、两种物质的阴离子半径都比阳离子半径小 | B、溶于水,所得溶液都能使无色酚酞变红 | C、与水反应时,水都做氧化剂 | D、与盐酸反应都只生成一种盐 |
下列说法中正确的是( )
| A、用碱石灰除去氯气中的水 | B、碘化银是重要的感光材料,溴化银可用于人工降雨 | C、过氧化钠可用作潜艇里氧气的来源 | D、焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察 |
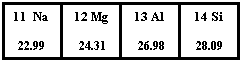 如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )
如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )| A、Si元素的名称是硅,其核电荷数为14 | B、Mg原子的结构示意图是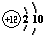 | C、Al的相对原子质量是26.98g | D、它们都属于金属元素 |
下列说法中正确的是( )
| A、O、Na、S元素的原子半径依次增大 | B、KOH、Mg(OH)2、Ba(OH)2的碱性依次增强 | C、H2SO4、H3PO4、HClO4的酸性依次增强 | D、F2、Cl2、Br2、I2的氧化性依次减弱 |