题目内容
【题目】下列叙述正确的是
A. 已知I3-![]() I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
B. 室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中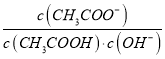 减小
减小
C. 室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立
D. 在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 H2O的电离常数Kb=![]()
【答案】CD
【解析】试题分析:A、向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,这说明平衡I3-![]() I2+I-加入适量CCl4后,有利于平衡I3-
I2+I-加入适量CCl4后,有利于平衡I3-![]() I2+I-向右移动,I2溶解在CCl4中显紫红色,A不正确;B、醋酸是弱酸,存在电离平衡,稀释促进电离。由于
I2+I-向右移动,I2溶解在CCl4中显紫红色,A不正确;B、醋酸是弱酸,存在电离平衡,稀释促进电离。由于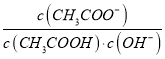 =
= =
=![]() ,因为温度不变,所以
,因为温度不变,所以 不变,B不正确;C、根据HF的电离常数大于醋酸的电离常数,所以醋酸钾的水解程度大于NaF的水解程度,即醋酸钾溶液的碱性强于NaF溶液的碱性。根据电荷守恒可知c(Na+)+c1(H+)=c(F-)+c1(OH-)、c(K+)+c2(H+)=c(CH3COO-) +c2(OH-),则c(Na+) -c(F-)=c1(OH-) -c1(H+)、c(K+)-c(CH3COO-)=c2(OH-) -c2(H+)。因为c1(OH-)<c2(OH-),c1(H+)>c2(H+),所以c(Na+) -c(F-)<c(K+)-c(CH3COO-),C不正确;D、在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+) =c(Cl-)=0.01 mol/L÷2=0.005mol/L。根据电荷守恒可知c(NH4+) +c(H+)=c(Cl-)+c(OH-),因此c(H+)=c(OH-)=10-7mol/L,而溶液中c(NH3·H2O)=(0.5a-0.005)mol/L,则根据氨水的电离常数表达式可知Kb=
不变,B不正确;C、根据HF的电离常数大于醋酸的电离常数,所以醋酸钾的水解程度大于NaF的水解程度,即醋酸钾溶液的碱性强于NaF溶液的碱性。根据电荷守恒可知c(Na+)+c1(H+)=c(F-)+c1(OH-)、c(K+)+c2(H+)=c(CH3COO-) +c2(OH-),则c(Na+) -c(F-)=c1(OH-) -c1(H+)、c(K+)-c(CH3COO-)=c2(OH-) -c2(H+)。因为c1(OH-)<c2(OH-),c1(H+)>c2(H+),所以c(Na+) -c(F-)<c(K+)-c(CH3COO-),C不正确;D、在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+) =c(Cl-)=0.01 mol/L÷2=0.005mol/L。根据电荷守恒可知c(NH4+) +c(H+)=c(Cl-)+c(OH-),因此c(H+)=c(OH-)=10-7mol/L,而溶液中c(NH3·H2O)=(0.5a-0.005)mol/L,则根据氨水的电离常数表达式可知Kb= =
=![]() =
=![]() ,D正确。
,D正确。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.lmol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL乙溶液,加入等体积水,醋酸的电离平衡___________(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体 (假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___________(填“增大”“ 减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙) (填“>”、“ <”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×l1-5 | 4.3×l0-7 | 3.0×10-8 |
K2 | - - | 5.6×10-11 | - - |
下列四种离子结合H+能力最强的是___________;
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=___________;取99mL甲溶液与lrnLlmol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______________。
