题目内容
7.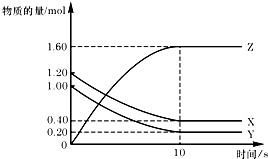 T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 平衡时X、Y的转化率相同 | |
| B. | 达到平衡后,将容器体积压缩为1L,平衡向正反应方向移动 | |
| C. | T℃时,该反应的化学方程式为:X(g)+Y(g)?2Z(g),平衡常数K=40 | |
| D. | T℃时,若起始时X为0.71mol,Y为1.00mol,则平衡时Y的转化率为60% |
分析 根据图知,X、Y是反应物而Z是生成物,达到平衡状态时,△n(X)=n(1.20-0.40)mol=0.80mol、△n(Y)=n(1.00-0.20)mol=0.80mol、△n(Z)=n(1.60-0.00)mol=1.60mol,同一可逆反应同一时间段内各物质物质的量变化量之比等于其计量数之比,所以该反应方程式中X、Y、Z的计量数之比为0.80mol:0.80mol:1.60mol=1:1:2,则该反应方程式为X(g)+Y(g)?2Z(g),
A.X、Y的转化率分别为:$\frac{0.80mol}{1.20mol}×100%$、$\frac{0.80mol}{1.00mol}×100%$;
B.该反应前后气体计量数之和不变,则压强不影响平衡移动;
C.反应达到平衡状态时,c(X)=$\frac{0.40mol}{2L}$=0.20mol/L,c(Y)=$\frac{0.20mol}{2L}$=0.10mol/L、c(Z)=$\frac{1.60mol}{2L}$=0.80mol/L,该反应平衡常数K=$\frac{{c}^{2}(Z)}{c(X).c(Y)}$;
D.温度不变,化学平衡常数不变,设参加反应的Y的物质的量为amol,根据方程式知,参加反应的X物质的量为amol,生成Z的物质的量为2amol,平衡时c(X)=$\frac{0.71-a}{2}$mol/L、c(Y)=$\frac{1.00-a}{2}$mol/L、c(Z)=$\frac{2a}{2}$mol/L=amol/L$\frac{a×a}{\frac{0.71-a}{2}×\frac{1.00-a}{2}}$=32,a=0.60,再结合转化率公式计算其转化率.
解答 解:根据图知,X、Y是反应物而Z是生成物,达到平衡状态时,△n(X)=n(1.20-0.40)mol=0.80mol、△n(Y)=n(1.00-0.20)mol=0.80mol、△n(Z)=n(1.60-0.00)mol=1.60mol,同一可逆反应同一时间段内各物质物质的量变化量之比等于其计量数之比,所以该反应方程式中X、Y、Z的计量数之比为0.80mol:0.80mol:1.60mol=1:1:2,则该反应方程式为X(g)+Y(g)?2Z(g),
A.X、Y的转化率分别为:$\frac{0.80mol}{1.20mol}×100%$=67%、$\frac{0.80mol}{1.00mol}×100%$=80%,故A错误;
B.该反应前后气体计量数之和不变,则压强不影响平衡移动,所以将容器体积压缩为1L,平衡不移动,故B错误;
C.反应达到平衡状态时,c(X)=$\frac{0.40mol}{2L}$=0.20mol/L,c(Y)=$\frac{0.20mol}{2L}$=0.10mol/L、c(Z)=$\frac{1.60mol}{2L}$=0.80mol/L,该反应平衡常数K=$\frac{{c}^{2}(Z)}{c(X).c(Y)}$=$\frac{0.80×0.80}{0.20×0.10}$=32,故C错误;
D.温度不变,化学平衡常数不变,设参加反应的Y的物质的量为amol,根据方程式知,参加反应的X物质的量为amol,生成Z的物质的量为2amol,平衡时c(X)=$\frac{0.71-a}{2}$mol/L、c(Y)=$\frac{1.00-a}{2}$mol/L、c(Z)=$\frac{2a}{2}$mol/L=amol/L$\frac{a×a}{\frac{0.71-a}{2}×\frac{1.00-a}{2}}$=32,a=0.60,Y转化率为$\frac{0.60mol}{1.00mol}×100%$=60%,故D正确;
故选D.
点评 本题以图象分析为载体侧重考查转化率、平衡常数的有关计算及化学平衡影响因素等知识点,同时考查学生分析计算能力,注意压强不影响该反应平衡移动,为易错点.

| A. | 某人的血糖检测结果为90mg/dL,他的血糖是正常(人的血糖正常值在3.61----6.11mmol/L,血糖相对分子质量180) | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 当光束通过有尘埃的空气、氯化铁溶液、墨水等分散系能观察到丁达尔现象 | |
| D. | 胶体属于介稳体系原因是胶体带电 |
| A. | 淀粉和纤维素 | B. | 甲酸乙酯与乙酸甲酯 | ||
| C. | 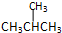 与 与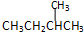 | D. |  与 与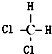 |
| A. | 20Ne和22Ne互为同位素 | B. | 20Ne和22Ne的电子数不同 | ||
| C. | 20Ne和22Ne的质量数相同 | D. | 20Ne和22Ne的中子数相同 |
| A. | 乙醇和CH3-O-CH3 | B. | CH3COOH和乙酸乙酯 | ||
| C. | O2和O3 | D. | 淀粉和纤维素 |
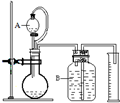 工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质.为测定碱中各成分的百分含量可采用滴定法、气体法等.
工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质.为测定碱中各成分的百分含量可采用滴定法、气体法等. 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: