题目内容
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对某类反应[aA(g)+bB(g)cC(g)]的化学平衡的影响,得到图像(图中p表示压强,T表示温度,n表示物质的量,α表示转化率)
反应Ⅰ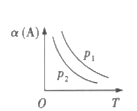 反应Ⅱ
反应Ⅱ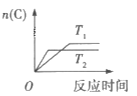
分析图像,回答下列问题:
(1)在反应I中,若![]() >
>![]() ,则该反应的正反应为__________(填“放热”或“吸热”)反应,且为气体分子数__________(填“减小”或“增大”)的反应;若此反应能自发进行,则必须满足的条件是__________
,则该反应的正反应为__________(填“放热”或“吸热”)反应,且为气体分子数__________(填“减小”或“增大”)的反应;若此反应能自发进行,则必须满足的条件是__________
(2)在反应II中,![]() __________(填“>”,“<”或“=”)
__________(填“>”,“<”或“=”)![]() ,该反应的正反应为__________(填“放热”或“吸热”)反应。
,该反应的正反应为__________(填“放热”或“吸热”)反应。
【答案】放热 减小 低温 < 放热
【解析】
在有多个变量的平衡图像分析时,常采用“定一议二”、“先拐先平”的方法进行分析;根据G=H-TS<0进行分析。
(1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,则正反应为放热反应,△H<0,由p1>p2知恒定温度时压强越大,α(A)越大,即增大压强平衡向右移动,说明此反应为气体分子数减少的反应,即为熵减反应,△S<0,放热、熵减反应只能在低温下自发进行,故答案为:放热;减小;低温;
(2)反应Ⅱ中先拐先平温度高,T2温度下反应先达到平衡状态,说明T2>T1,温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应,△H<0,故答案为:<;放热。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目