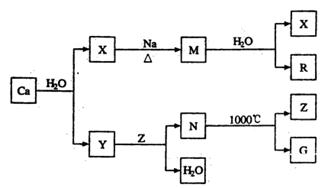
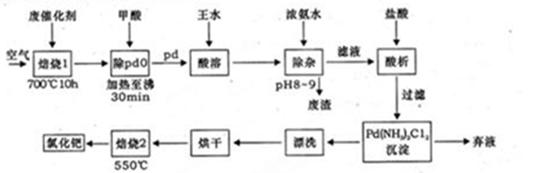
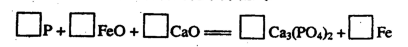题目内容
仔细阅读下列三段文字
①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液中,溶液逐渐变为紫红色且pH不断减小。
②将0.08 mol KMnO4固体(质量为12.64 g)加热一段时间后,收集到a mol O2;向反应后残留的固体中加入足量的浓盐酸,又收集到b mol Cl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
③氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:Cl2+2e- =2Cl- 。
回答问题:
(1)试写出①有关的离子方程式:________________________________________________。
(2)请配平②的化学方程式:
____KMnO4+____HCl -______KCl+ _____MnCl2+_____Cl2↑+____ H2O
通过对第②段文字中提供的数据进行计算可得出:a +b的最大值为 ____ ,a +b最小值为_____。
(3)下列四种物质中能使③中的还原过程发生的物质是________。
| A.Na2CO3 | B.KMnO4 | C.XeO3 | D.Na2SO3 |

(1)5XeO3 + 6Mn2+ + 9H2O =" 5Xe" + 6MnO4—+18H+(2分)
(2)2、16 = 2、2、5、8,(2分) 0.2, 0.16 (各2分)
(3)D (2分) 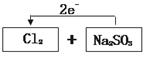 (2分)
(2分)
解析试题分析:
(1)有信息“溶液逐渐变为紫红色且pH不断减小”可知,二者发生了氧化还原反应。
(2)根据化合价升降配平方程式。
(3)此处需要选择一个还原剂。
考点:本题考查了氧化还原反应的书写,电子转移等知识。

(1)某化学课外小组用海带为原料制取少量碘水,现在用四氯化碳在碘水中萃取碘单质,并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
| A.把盛有溶液的分液漏斗敖在铁架台的铁圈中: |
| B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞: |
| C.检验分液漏斗活塞和上口玻璃塞是否漏液; |
| D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞: |
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗口上的小孔:
H.静置、分层。就此实验,完成下列填空:
正确操作步骤的顺序是: 。
(2)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82?+H2O—MnO4?+SO42?+H+
该反应常用于检验Mn2+的存在。其特征现象是 。
若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2SO4— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目:
②上述反应中还原产物是
(16分)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如右表。
| | 开始沉淀的pH | 完全沉淀的pH |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |

①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示) 。
②请补充并配平以下反应池中发生主要反应的离子方程式:
Cr2O72-+ HSO3-+ == Cr3++ SO42-+ H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和 ____________________________ 。证明Cr3+沉淀完全的方法是 。
(2)工业可用电解法来处理含Cr2O72-废水。实验室利用如右下图模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。

①Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是 ;
②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因 。
③若溶液中含有0.01mol Cr2O72-,则阳离子全部生成沉淀的物质的量是_______mol。