��Ŀ����
����Ŀ����A��B��C��D����Ԫ�أ�����AԪ�غ�BԪ�ص�ԭ�Ӷ���1��δ�ɶԵ��ӣ�A+��B����һ�����Ӳ㣬Bԭ�ӵ�һ�����Ӻ�3p���ȫ����Cԭ�ӵ�p�������3��δ�ɶԵ��ӣ�����̬�⻯����ˮ�е��ܽ����ͬ��Ԫ�����γɵ��⻯�������D������ϼۺ���ͻ��ϼ۵Ĵ�����Ϊ4��������������к�D����������Ϊ40%���������������������������R����A��D��Ԫ���γɵ����ӻ��������A��D������֮��Ϊ2��1����ش��������⣺
��1��A���ʡ�B���ʡ�������R���۵��С˳��Ϊ���е�������ţ���A���ʣ�B���ʣ�R�� ��R��A���ʣ�B���ʣ�
��B���ʣ�R��A���ʣ� ��A���ʣ�R��B���ʣ�
��2����CB3������CԪ��ԭ�ӵ�ԭ�ӹ�����������ӻ��������ʱ�ľ�������Ϊ ��
��3��д��Dԭ�ӵĺ�������Ų�ʽ �� C���⻯���D���⻯����ˮ���ܽ�ȴ�ö�Ŀ���ԭ�� ��
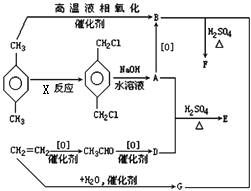
��4����ͼ��D��Fe�γɵľ���FeD2��С��Ԫ����������FeD2������������������֮��Ϊ �� FeD2�����о��еĻ�ѧ������Ϊ �� 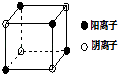
���𰸡�
��1����
��2��sp3�����Ӿ���
��3��1s22s22p63s23p4���������Ӻ�ˮ���Ӽ����γ�������ܷ�����ѧ��Ӧ
��4��1��1�����Ӽ������ۼ�
���������⣺A��B��C��D����Ԫ�أ�Bԭ�ӵ�һ�����Ӻ�3p���ȫ������B��ClԪ�أ�A+��B����һ�����Ӳ㣬��A��NaԪ�أ�Cԭ�ӵ�p�������3��δ�ɶԵ��ӣ���Ϊ��VA��Ԫ�أ�����̬�⻯����ˮ�е��ܽ����ͬ��Ԫ�����γɵ��⻯�������˵�����⻯�����ܺ�ˮ�γɷ��Ӽ����������C��NԪ�أ�D������ϼۺ���ͻ��ϼ۵Ĵ�����Ϊ4�����ڢ�A�壬������������к�D����������Ϊ40%�������������������������������D��SԪ�أ�R����A��D��Ԫ���γɵ����ӻ��������A��D���ӵ���Ŀ֮��Ϊ2��1����R��Na2S����1��A���ʡ�B���ʡ�������R�ֱ���Na��Cl2��Na2S�����������Ӿ��壬���ǽ������壬���������Ƿ��Ӿ��壬����Na���۵�ܵͣ��ʾ����۵�ߵ�˳���ǣ�R��A���ʣ�B���ʣ���ѡ�ڣ���2��NCl3�����е�ԭ�Ӻ���3�����۵����Һ���һ���µ��Ӷԣ�Nԭ�Ӳ�ȡsp3�ӻ������̬ʱ�ľ����й������Ƿ��ӣ����Ծ�������Ϊ���Ӿ��壬���Դ��ǣ�sp3�����Ӿ��壻��3��D��SԪ�أ�ԭ�ӵĺ�������Ų�ʽ1s22s22p63s23p4 �� C���⻯����NH3 �� D���⻯����H2S���������Ӻ�ˮ���Ӽ����γ�������ܷ�����ѧ��Ӧ�����°����ܽ��Դ������⣬���Դ��ǣ�1s22s22p63s23p4���������Ӻ�ˮ���Ӽ����γ�������ܷ�����ѧ��Ӧ����4��FeS2��������������ĿΪ4�� ![]() =
= ![]() ����������ĿΪ4��
����������ĿΪ4�� ![]() =
= ![]() ���������ӡ���������֮��Ϊ1��1��FeS2�����к������Ӽ���S22�����й��ۼ������Դ��ǣ�1��1�����Ӽ������ۼ���
���������ӡ���������֮��Ϊ1��1��FeS2�����к������Ӽ���S22�����й��ۼ������Դ��ǣ�1��1�����Ӽ������ۼ���

����Ŀ��CO��CO2�ǻ������糧�ͷų�����Ҫβ����Ϊ���ٶԻ�����ɵ�Ӱ�죬���糧��ͼ�������·���������Դ�����ã����»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
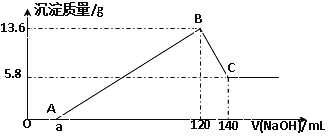
��1��CO ��Cl2�ڴ����������ºϳɹ���(COCl2)��ij�¶��£���2L���ܱ�������Ͷ��һ������CO��Cl2,�ڴ����������·�����Ӧ��CO(g)+Cl2(g)![]() COCl2(g) ;��H=akJ/mol ��Ӧ�����вⶨ�IJ����������±���
COCl2(g) ;��H=akJ/mol ��Ӧ�����вⶨ�IJ����������±���
t/min | n (CO) /mol | n(Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
����Ӧ1~2minĩ��ƽ������v(COCl2)=________mol/(L��min)��
����2min~4min�䣬vCl2��_______vCO�� (����>������=������<��)�����¶���K=________��
����֪X��L�ɷֱ�����¶Ȼ�ѹǿ����ͼ��ʾLһ��ʱ��CO��ת������X�ı仯��ϵ��
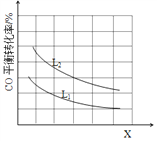
X��������������___________��a_______0 (�>������=������<��)��
��2���ڴ���������NO��COת��Ϊ��������2CO(g) +2NO(g)![]() 2CO2(g) +N2(g);��H=-748kJ��mol-1
2CO2(g) +N2(g);��H=-748kJ��mol-1
��һ�������£���λʱ���ڲ�ͬ�¶��²ⶨ�ĵ�������ת������ͼ1��ʾ���¶ȸ���710Kʱ�����¶ȵ����ߵ�������ת���ʽ��͵�ԭ�������________________________________________________��
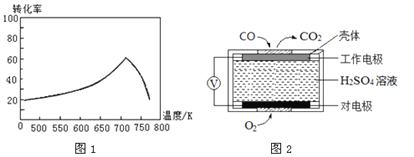
����֪�� �ⶨ������NO��CO�������õķ�����������
����1���绯ѧ������������������CO �������Ĺ���ԭ����ͼ2 ��ʾ�������缫�ķ�ӦʽΪ____________��
����2��������ԭ�ζ�������H2O2��Һ����β��������������ת��Ϊǿ��,������к͵ζ����ⶨǿ�����ȡ�д��NO��H2O2��Һ��Ӧ�����ӷ���ʽ��____________��