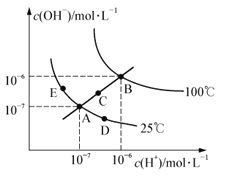
题目内容
【题目】A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D、C=E、A+B=C
Ⅲ.原子的核外电子层数:B=C=2A、D=E
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
V.F的单质或合金是用量最大的金属材料
请回答:
(1)甲是由A、B两种元素按原子个数比为3:1组成的物质,乙是由C、D两种元素按原子个数比为1:2组成的物质,用电子式分别表示甲和乙的形成过程:
甲:;
乙: .
(2)写出含F的黑色磁性氧化物与B元素的最高价氧化物对应的水化物的稀溶液反应的离子方程式: .
(3)上述元素A、B、C、D、E、F中五种元素可形成一种常见复盐,经检测该复盐由三种离子组成,且离子个数比为1:1:2,向该盐溶液中加入酸化的BaCl2溶液产生白色沉淀;加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则该复盐的化学式为:;
(4)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol BaCl2固体完全反应后,该溶液中c(SO42﹣)为(已知:忽略溶液体积变化.该沉淀的KSP=2×10﹣9)
【答案】
(1)![]() ;
;![]()
(2)3Fe3O4+28H++NO3﹣=9Fe3++NO↑+14H2O
(3)NH4Fe(SO4)2
(4)5×10﹣9mol/L
【解析】解:A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.原子的核外电子层数:B=C=2A,则A处于第一周期,B、C处于第二周期,则A为H元素;B元素的主要化合价:最高正价+最低负价=2,B处于ⅤA族,则B为N元素;原子的最外层电子数:A=D,C=E,则A、D同主族,C、E同主族,可推知D为Na,最外层电子数A+B=C,则C的最外层电子数=1+5=6,可推知C为O元素、E为S元素;F的单质或合金是用量最大的金属材料,(1)由H、N两种元素按原子数之比为3:1组成的物质甲为NH3 , 用电子式表示形成过程为 ![]() ,
,
由O、Na两种元素按原子个数比为1:2组成的物质乙为Na2O,用电子式表示形成过程为 ![]() ,
,
所以答案是: ![]() ;
; ![]() ;(2)含Fe元素的黑色磁性氧化物为Fe3O4 , 与稀硝酸反应生成硝酸铁、NO与水,反应离子方程式为:3Fe3O4+28H++NO3﹣=9Fe3++NO↑+14H2O,
;(2)含Fe元素的黑色磁性氧化物为Fe3O4 , 与稀硝酸反应生成硝酸铁、NO与水,反应离子方程式为:3Fe3O4+28H++NO3﹣=9Fe3++NO↑+14H2O,
所以答案是:3Fe3O4+28H++NO3﹣=9Fe3++NO↑+14H2O;(3)上述元素中H、N、O、S、Fe的五种元素可形成一种常见复盐,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀,该盐含有SO42﹣ , 加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,该盐含有NH4+ , 经检测该复盐由三种离子组成且离子个数比为1:1:2,由电荷守恒可知,含有Fe3+ , 则该复盐的化学式为NH4Fe(SO4)2 ,
所以答案是:NH4Fe(SO4)2;(4)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,溶液中c(Ba2+)≈ ![]() ﹣0.1mol/L×2=0.4mol/L,该溶液中c(SO42﹣)×c(Ba2+)=2×10﹣9 , 故c(SO42﹣)=5×10﹣9mol/L,
﹣0.1mol/L×2=0.4mol/L,该溶液中c(SO42﹣)×c(Ba2+)=2×10﹣9 , 故c(SO42﹣)=5×10﹣9mol/L,
所以答案是:5×10﹣9mol/L.

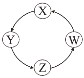
【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①②③ B. ①③④ C. ②③ D. ①④