题目内容
(2009?山东)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2 (g)+3H2(g)=2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡
(2)已知:O2 (g)=O2+(g)+e-△H1=1175.7kJ?mol-1
PtF6(g)+e-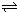 =PtF6-(g)△H2=-771.1kJ?mol-1
=PtF6-(g)△H2=-771.1kJ?mol-1
O2+PtF6-(S)=O2+ (g)+PtF6-(g)△H3=482.2kJ?mol-1
则反应O2(g)+PtF6(g)=O2+PtF6-(S) 的△H=
(3)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-).则溶液显
mol?L-1
mol?L-1.
(1)合成氨反应N2 (g)+3H2(g)=2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡
向左
向左
移动(填“向左”“向右”或“不”);使用催化剂不改变
不改变
反应的△H(填“增大”“减小”或“不改变”).(2)已知:O2 (g)=O2+(g)+e-△H1=1175.7kJ?mol-1
PtF6(g)+e-
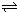 =PtF6-(g)△H2=-771.1kJ?mol-1
=PtF6-(g)△H2=-771.1kJ?mol-1O2+PtF6-(S)=O2+ (g)+PtF6-(g)△H3=482.2kJ?mol-1
则反应O2(g)+PtF6(g)=O2+PtF6-(S) 的△H=
-78.2
-78.2
kJ?mol-1.(3)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为2NH3?H2O+Cu2+=Cu(OH)2↓+2NH4+
2NH3?H2O+Cu2+=Cu(OH)2↓+2NH4+
.已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-).则溶液显
中
中
性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
分析:(1)由恒温、恒压条件下向平恒体系中通入氩气,则反应体系的体积增大,由催化剂只能改变反应途径而不能改变反应的始终态来分析;
(2)根据盖斯定律来分析已知的反应与目标反应的关系,然后计算反应热;
(3)根据难溶物的溶度积来分析先沉淀的物质,然后书写离子反应方程式,注意弱电解质应保留化学式来解答;
(4)根据电荷守恒及反应平衡时溶液中c(NH4+)=c(Cl-)分析溶液的酸碱性,利用离子浓度来计算电离常数.
(2)根据盖斯定律来分析已知的反应与目标反应的关系,然后计算反应热;
(3)根据难溶物的溶度积来分析先沉淀的物质,然后书写离子反应方程式,注意弱电解质应保留化学式来解答;
(4)根据电荷守恒及反应平衡时溶液中c(NH4+)=c(Cl-)分析溶液的酸碱性,利用离子浓度来计算电离常数.
解答:解:(1)恒温、恒压条件下向平恒体系中通入氩气,则反应体系体积增大,相当于压强减小,则平衡向气体体积增大的方向移动,即左移;
因使用催化剂只是改变了反应的途径,没有改变反应物与生成物的状态,则△H不变,故答案为:向左;不改变;
(2)①O2 (g)=O2+(g)+e-△H1=1175.7kJ?mol-1
②PtF6(g)+e-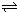 =PtF6-(g)△H2=-771.1kJ?mol-1
=PtF6-(g)△H2=-771.1kJ?mol-1
③O2+PtF6-(S)=O2+ (g)+PtF6-(g)△H3=482.2kJ?mol-1
利用盖斯定律,则①+②-③可得反应O2(g)+PtF6(g)=O2+PtF6-(S),则△H=△H1+△H2-△H3=-78.2 kJ?mol-1,故答案为:-78.2;
(3)由于KsP[Cu(OH)2]=2.2×10-20<Ksp[Mg(OH)2]=1.8×10-11,所以Cu(OH)2先生成沉淀;一水合氨、氢氧化铜在书写离子方程式应保留化学式,
则离子方程式为2NH3?H2O+Cu2+=Cu(OH)2↓+2 NH4+,故答案为:Cu(OH)2;2NH3?H2O+Cu2+=Cu(OH)2↓+2 NH4+;
(4)根据溶液的电中性原则,c(NH4+)=c(Cl-),则c(H+)=c(OH-),则溶液显中性;
又Kb=
,c(NH4+)=c(Cl-)=0.005 mol?L-1;[H+]=[OH-]=1×10-7 mol?L-1(因为是25℃下且为中性);
[NH3?H2O]=
mol?L-1-0.005 mol?L-1,则Kb=
mol?L-1,故答案为:
mol?L-1.
因使用催化剂只是改变了反应的途径,没有改变反应物与生成物的状态,则△H不变,故答案为:向左;不改变;
(2)①O2 (g)=O2+(g)+e-△H1=1175.7kJ?mol-1
②PtF6(g)+e-
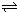 =PtF6-(g)△H2=-771.1kJ?mol-1
=PtF6-(g)△H2=-771.1kJ?mol-1③O2+PtF6-(S)=O2+ (g)+PtF6-(g)△H3=482.2kJ?mol-1
利用盖斯定律,则①+②-③可得反应O2(g)+PtF6(g)=O2+PtF6-(S),则△H=△H1+△H2-△H3=-78.2 kJ?mol-1,故答案为:-78.2;
(3)由于KsP[Cu(OH)2]=2.2×10-20<Ksp[Mg(OH)2]=1.8×10-11,所以Cu(OH)2先生成沉淀;一水合氨、氢氧化铜在书写离子方程式应保留化学式,
则离子方程式为2NH3?H2O+Cu2+=Cu(OH)2↓+2 NH4+,故答案为:Cu(OH)2;2NH3?H2O+Cu2+=Cu(OH)2↓+2 NH4+;
(4)根据溶液的电中性原则,c(NH4+)=c(Cl-),则c(H+)=c(OH-),则溶液显中性;
又Kb=
| [OH-][NH4*] |
| [NH3?H2O] |
[NH3?H2O]=
| a |
| 2 |
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
点评:本题考查化学平衡移动、反应热的计算、溶度积、溶液的酸碱性、电离常数,综合性较强,注重学生基础知识和基本技能的考查,有助于训练学生解决问题的能力.

练习册系列答案
相关题目