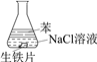题目内容
【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中___(填“s”、“p”、“d”或“ds”)区。[Ag2(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是___。
(2)下表是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1 mol该配离子中含σ键数目为____。
②该配合物中存在的作用力类型有_____(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO2的熔点(1660℃C)比MnS的熔点(1610℃)高,其主要原因是_________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。
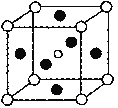
①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于____位置,X处于____位置。
③CH3NH3PbI3晶体的晶胞参数为anm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为______。
【答案】ds 直线形 失去第二个电子时,Cu 失去的是全充满 3d10 电子,Fe 失去的是 4s1 电子 ![]() 12 NA BCD 二者均为离子晶体,O2-半径小于 S2-半径,MnO 的晶格能大于 MnS 体心 面心 620/(a×10-7)3d
12 NA BCD 二者均为离子晶体,O2-半径小于 S2-半径,MnO 的晶格能大于 MnS 体心 面心 620/(a×10-7)3d
【解析】
(1)Ag位于第五周期第ⅠB族,外围电子排布为4d55s1,属于ds区;
[Ag2(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,所以其空间构型为直线型结构;
(2)根据表中数据可知,I2(Cu)大于I2( Fe),主要原因为:失去第二个电子时,Cu 失去的是全充满 3d10 电子,Fe 失去的是 4s1 电子;
(3)①CN-中碳与氮之间形成三对共用电子对,电子式是![]() ;1 mol该配离子[Fe(CN)6]4-中,CN-与铁离子之间有6个配位键,在每个CN-内部有一个共价键,所以1mol该配合物中含有σ键的数目为12NA;
;1 mol该配离子[Fe(CN)6]4-中,CN-与铁离子之间有6个配位键,在每个CN-内部有一个共价键,所以1mol该配合物中含有σ键的数目为12NA;
②K4[Fe(CN)6]中钾离子与[Fe(CN)6]4-之间形成离子键、[Fe(CN)6]4-中CN-与铁离子之间形成配位键、CN-中碳原子与氮原子之间形成共价键,故存在的作用力类型有离子键、共价键、配位键。答案选BCD;
(4)MnO2的熔点(1660℃)比MnS的熔点(1610℃)高,其主要原因是二者均为离子晶体,O2-半径小于 S2-半径,MnO 的晶格能大于 MnS;
(5)①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,根据图中离子的位置关系可知,M处于体心位置,X处于面心位置;
③CH3NH3PbI3晶体的晶胞参数为anm,其晶体密度为dg·cm-3,根据![]() 可知 dg·cm-3=
可知 dg·cm-3=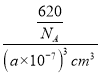 ,则阿伏加德罗常数的值NA的计算表达式为
,则阿伏加德罗常数的值NA的计算表达式为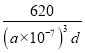 。
。

【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
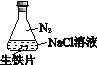
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
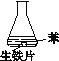
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2