题目内容
苯乙烯是现代石油化工产品中最重要的单体之一。在工业上,苯乙烯可由乙苯和CO2
催化脱氢制得。总反应原理如下: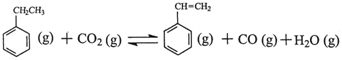 △H
△H
回答下列问题:
(1)乙苯在CO2气氛中的反应可分两步进行: △H1=+117.6kJ·mol-1
△H1=+117.6kJ·mol-1
H2 (g)+CO2 (g) CO (g)+H2O (g) △H2=+41.2kJ·mol-1
CO (g)+H2O (g) △H2=+41.2kJ·mol-1
由乙苯制取苯乙烯反应的 。
。
(2)在温度为T1时,该反应的平衡常数K=0.5mol/L。在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得混合物中各组分的物质的量均为1.0mol。
①该时刻化学反应 (填“是”或“不是”)处于平衡状态;
②下列叙述能说明乙苯与CO2在该条件下反应已达到平衡状态的是 (填正确答案编号);
a.正、逆反应速率的比值恒定 b.c(CO2)=c(CO)
c.混合气体的密度不变 d.CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度 (填正确答案编号)
| A.大于0.5mol/L | B.小于0.5mol/L |
| C.等于0.5mol/L | D.不确定 |
 ,则反应达到平衡时苯乙烯的浓度为 , (均用含
,则反应达到平衡时苯乙烯的浓度为 , (均用含 、P的表达式表示)。
、P的表达式表示)。(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式 。
(1)+158.8kJ·mol-1(2分)(2)①是(2分) ②abd (3分) ③d(2分)
(3) mol·L-1 (2分)
mol·L-1 (2分)  ×100%(2分)
×100%(2分)
(4) (2分)
(2分)
解析试题分析:(1)根据盖斯定律,两个方程式合并就得到乙苯制取苯乙烯反应的 +158.8kJ·mol-1。
+158.8kJ·mol-1。
(2)①在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得混合物中各组分的物质的量均为1.0mol,所以各组分的浓度都是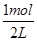 =0.5mol·L-1,QC=
=0.5mol·L-1,QC= =0.5=K,所以该时刻化学反应是处于平衡状态;
=0.5=K,所以该时刻化学反应是处于平衡状态;
②ad两个选项都容易看出可以作为标志,要注意的是b,c(CO2)=c(CO)代表各组分的浓度相等,实际上就是①的情况,所以也可以说明是达到了平衡状态。c错,因为该反应实在在2L的密闭容器中加入乙苯与CO2,所以体积不变,根据质量守恒,气体的质量也不变,所以密度是一个定制,不能作为达到平衡的标志,所以c不能选。
③因为该反应前后系数不等,恒压就要扩大体积,平衡向正向移动,因为该反应正向是吸热反应,绝热要向逆向移动,所以恒压绝热两个因素都在变化,不确定向哪个方向移动,所以乙苯的物质的量浓度不能确定。
(3)三段法
起始浓度 2.0 3.0 0 0 0
转化浓度 x x x x x
平衡浓度 2.0-x 3.0-x x x x  =
=
反应达到平衡时苯乙烯的浓度为x= mol·L-1
mol·L-1
乙苯的转化率为 ×100%
×100%
(4)根据双键的性质,加聚反应的规律即可写出 。
。
考点:考查化学反应原理的知识。

甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
__________________________________________________________。
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)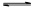 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正 V逆(填“<” ,“>” ,“=”)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为 _______________mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式: 。
氮是地球上含量丰富的—种元素,氮及其化合物在工农业生产、生活中有着重要作用,
减少N 的氧化物在大气中的排放是环境保护的重要内容之一。
(1)上图是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________________________________________;
又知:N2(g)+ O2(g)=2NO(g) △H=+180kJ/mol;2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol,则反应2NO(g)+2CO(g) N2(g)+ 2CO2(g)的△H=_______________;
N2(g)+ 2CO2(g)的△H=_______________;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g) + O2(g) 2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
①写出该反应的平衡常数表达式:K=__________,己知:K300℃>K350℃,则该反应是______热反应。
②反应达到平衡后,NO2的转化率为________________,此时若再通入一定量氮气,则NO2的转化率将___________(填“增大”、“减小”、“不变”);
③图中表示N2O5的浓度的变化曲线是____,用O2表示从0~500 s内该反应的平均速率v=________。

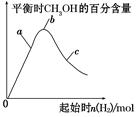
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1