题目内容
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)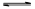 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正 V逆(填“<” ,“>” ,“=”)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为 _______________mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式: 。
(1)①1/ 6或0.17 ②<1 (填0<a/b<1亦可) ③<
(2)CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol
(3)c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-) (4)5.6×10—5
(5)CH3OCH3-12e—+3H2O=3CO2+12H+
解析试题分析:(1)①、平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=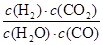 =
=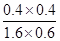 =0.17。
=0.17。
②由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2的转化率,则增大H2的物质的量,即a/b 的值小于1,
③由①900℃时,该反应的平衡常数为0.17,实验4,在900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时浓度商Qc=1,大于平衡常数0.17,故反应向逆反应进行,所以V正<V逆,
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ·mol-1
③H2O(g)=H2O(l)△H=-44.0kJ·mol-1
依据盖斯定律①-②+③×4得:2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l)△H=-885.6KJ·mol-1;
即CH3OH(l)+O2(g)="CO" (g)+2H2O(l)△H=-442.8KJ·mol-1;
(3)向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液,二者恰好反应,所得溶液为NaHC2O4溶液,在该溶液中,直接电离出的Na+和HC2O4-浓度最大,NaHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解,所以c(Na+)>c(HC2O4-),c(H+)> c(OH-)。,溶液中水电离生成氢离子,故c(H+)>c(C2O42-),溶液呈酸,电离产生的c(C2O42-)原大于 c(OH-)。,溶液中离子浓度c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-)。
(4)Na2CO3溶液的浓度为1×10-4mol·L-1,等体积混合后溶液中c(CO32-)= ×2×10-4mol·L-1=1×10-4mol·L-1,根据Ksp=c(CO32-)·c(Ca2+)=2.8×10-9可知,钙离子最小浓度c(Ca2+)=
×2×10-4mol·L-1=1×10-4mol·L-1,根据Ksp=c(CO32-)·c(Ca2+)=2.8×10-9可知,钙离子最小浓度c(Ca2+)= mol·L-1=2.8×10-5mol·L-1,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol·L-1=5.6×10—5mol·L-1。
mol·L-1=2.8×10-5mol·L-1,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol·L-1=5.6×10—5mol·L-1。
(5)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.二甲醚放电生成二氧化碳与氢离子,电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+。
考点:考查化学平衡、反应热、以及难溶电解质的溶解平衡等问题。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案苯乙烯是现代石油化工产品中最重要的单体之一。在工业上,苯乙烯可由乙苯和CO2
催化脱氢制得。总反应原理如下: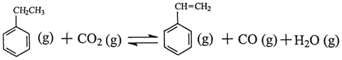 △H
△H
回答下列问题:
(1)乙苯在CO2气氛中的反应可分两步进行: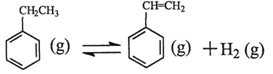 △H1=+117.6kJ·mol-1
△H1=+117.6kJ·mol-1
H2 (g)+CO2 (g) CO (g)+H2O (g) △H2=+41.2kJ·mol-1
CO (g)+H2O (g) △H2=+41.2kJ·mol-1
由乙苯制取苯乙烯反应的 。
。
(2)在温度为T1时,该反应的平衡常数K=0.5mol/L。在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得混合物中各组分的物质的量均为1.0mol。
①该时刻化学反应 (填“是”或“不是”)处于平衡状态;
②下列叙述能说明乙苯与CO2在该条件下反应已达到平衡状态的是 (填正确答案编号);
a.正、逆反应速率的比值恒定 b.c(CO2)=c(CO)
c.混合气体的密度不变 d.CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度 (填正确答案编号)
| A.大于0.5mol/L | B.小于0.5mol/L |
| C.等于0.5mol/L | D.不确定 |
 ,则反应达到平衡时苯乙烯的浓度为 , (均用含
,则反应达到平衡时苯乙烯的浓度为 , (均用含 、P的表达式表示)。
、P的表达式表示)。(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式 。
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g) CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。(3)CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)
 CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | | |
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)__________________________
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g)
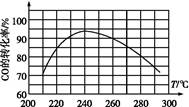
 2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。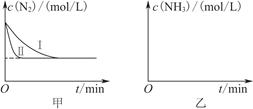
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为________________________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
②利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式___________________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
测得CH3OH的物质的量随时间变化如上图所示,回答问题:
①下列措施中能使n(CH3OH)/n(CO2)增大的是________。
| A.升高温度 | B.充入He(g)使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1 mol CO2和3 mol H2 |
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的
 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。(3)用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1的NaOH溶液和20.00 mL 0.10 mol·L-1氨水所得的滴定曲线如下:

请指出盐酸滴定氨水的曲线为________(填“A”或“B”),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序________。
运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)氨气、空气可以构成燃料电池.其电池反应原理为4NH3+3O2=2N2+6H2O。则电解质溶液应该显 (填“酸性”“中性”或“碱性”).正极的电极反应式为 。
(2)25℃时.将amol·L—1的氨水与0.1mol·L—1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-))时.则反应的情况可能为 。
A.盐酸不足.氨水剩余 B.氨水与盐酸恰好完全反应 C.盐酸过量
②当溶液中c(NH4+)=c(Cl-))时.用含“a”的代数式表示NH3·H2O的电离平衡常数Kb=______________.
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g) 2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
①写出该反应的化学平衡常数的表达式:__________,b________(填“大于”“小于”或“等于”)0
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)_________(填“大于”“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ?H="-1266.8KJ/mol" ;②N2(g)+O2(g)=2NO(g) ?H=+180.5KJ/mol,写出氨高温催化氧化的热化学方程式: 。
 SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。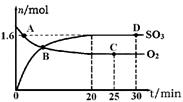
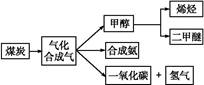
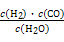 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:  CH3OH(g)
CH3OH(g)