题目内容
(共14分)
I . 为除去下列物质中所混有的少量杂质,写出选择的试剂并写出有关离子方程式。
(1)铁粉中混有少量SiO2,可选用试剂 ,
离子方程式 ;
(2)FeCl3溶液中混有少量FeCl2,可选用试剂 ,
离子方程式 。
II . 将下列H2SO4性质的序号,填入各小题后面对应的横线上。
A.脱水性 B.强酸性 C.难挥发性 D.氧化性 E.吸水性
(1)用浓H2SO4可以干燥SO2气体
(2)在烧杯中放入蔗糖,滴入浓H2SO4,变黑色
(3)在冷的浓H2SO4中放入铝片没有明显现象
III . KClO3和浓盐酸在常温下反应生成氯气:KClO3+6HCl(浓)= KCl+ 3Cl2↑+ 3H2O
(1)氧化剂是 ,还原产物是 。
(2)若有12.25g KClO3发生反应,则转移的电子的物质的量为 mol
(3)下列物质能使干燥的蓝色石蕊试纸先变红再褪色的是 (填序号)
①氯气 ②液氯 ③新制氯水 ④敞口放置的久置氯水⑤盐酸 ⑥加了醋酸的漂白粉溶液
I . 共6分(1) NaOH溶液(1分), SiO2+2OH—= SiO32-+H2O (2分)
(2)Cl2(1分) Cl2+2Fe2+=2 Fe3+2Cl- (2分) 。
II共3分 E(1分)、A(1分)、D(1分)
III .共5分 (1)KClO3(1分) Cl2(1分)(2)0.5(2分)(3)③⑥(1分)
解析:略

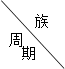
(共14分)下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
|
| ⅠA |
|
|
|
|
|
| 0 |
| 1 |
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
| 2 |
|
|
| D | E |
| G | I |
| 3 | A | B | C |
| F |
| H |
|
(1)表中元素,化学性质最不活泼的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)要证明A、B、C的金属活泼性,可以用什么实验来证明,试举一例
实验操作 ;
实验现象: ;
有关化学方程式:
(4)G与H的气态氢化物稳定性 > ,说明相应单质的非金属性 > 。
(共14分)
I . 为除去下列物质中所混有的少量杂质,写出选择的试剂并写出有关离子方程式。
(1)铁粉中混有少量SiO2,可选用试剂 ,
离子方程式 ;
(2)FeCl3溶液中混有少量FeCl2,可选用试剂 ,
离子方程式 。
II . 将下列H2SO4性质的序号,填入各小题后面对应的横线上。
| A.脱水性 | B.强酸性 | C.难挥发性 | D.氧化性 E.吸水性 |
(2)在烧杯中放入蔗糖,滴入浓H2SO4,变黑色
(3)在冷的浓H2SO4中放入铝片没有明显现象
III . KClO3和浓盐酸在常温下反应生成氯气:KClO3+6HCl(浓)=" KCl+" 3Cl2↑+ 3H2O
(1)氧化剂是 ,还原产物是 。
(2)若有12.25g KClO3发生反应,则转移的电子的物质的量为 mol
(3)下列物质能使干燥的蓝色石蕊试纸先变红再褪色的是 (填序号)
①氯气 ②液氯 ③新制氯水 ④敞口放置的久置氯水 ⑤盐酸 ⑥加了醋酸的漂白粉溶液
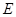 可以发生反应:2E+I
可以发生反应:2E+I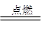 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.