题目内容
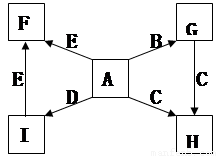
(每空2分,共14分)下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
① G是一种红棕色粉末、C既能与盐酸又能与NaOH溶液反应
② I是一种常见的温室气体,它和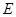 可以发生反应:2E+I
可以发生反应:2E+I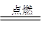 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)写出G→H的化学方程式为________________________;
此反应在工业上常用于焊接钢轨,实验室在演示该实验时,在装置中加入G、C混合物后,引发此反应的操作是 ;
(2)化合物Ⅰ的电子式为______________________,
(3)用适量的盐酸溶解G后,所得溶液叫蚀铜剂,常用来洗涤印刷电路板上的铜,写出该反应的离子方程式为________________;
(4)E在I中燃烧观察到的现象是_______________________。
(5)在氩气的保护下,将一定计量的C、E加热熔炼可获得一种潜在的贮氢材料E17C12 ,该材料吸氢的反应方程式为E17C12+17H2 = 17EH2+12C
①熔炼制备贮氢材料E17C12时通入氩气的目的是
②1mol E17C12完全吸氢后,将得到的产物与足量的盐酸完全反应。释放出H2的物质的量为
(每空2分,共14分)(1) 2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
在混合物上面加少量氯酸钾,中间插一根打磨过的镁条,点燃镁条
(2)
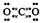 (3)
2Fe3++Cu=2Fe2++Cu2+
(3)
2Fe3++Cu=2Fe2++Cu2+
(4) 镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳
(5) 隔绝空气,防止镁和铝被氧气氧化 , 52mol
【解析】本题是无机框图题,关键是找准突破点。I是一种常见的温室气体,则I是CO2。根据2E+I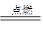 2F+D,F中的E元素的质量分数为60%可知,E是镁,F是氧化镁,D是碳,因此A是氧气。G是一种红棕色粉末,所以G是氧化铁。C既能与盐酸又能与NaOH溶液反应,且C是单质,所以C是铝,则H是氧化铝。
2F+D,F中的E元素的质量分数为60%可知,E是镁,F是氧化镁,D是碳,因此A是氧气。G是一种红棕色粉末,所以G是氧化铁。C既能与盐酸又能与NaOH溶液反应,且C是单质,所以C是铝,则H是氧化铝。
(1)G生成H的反应是铝热反应,所以方程式是2Al+Fe2O3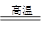 Al2O3+2Fe;引发铝热反应的正确操作是在混合物上面加少量氯酸钾,中间插一根打磨过的镁条,点燃镁条。
Al2O3+2Fe;引发铝热反应的正确操作是在混合物上面加少量氯酸钾,中间插一根打磨过的镁条,点燃镁条。
(2)CO2是含有极性键的共价化合物,所以电子式是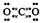 。
。
(3)氧化铁溶于水生成氯化铁,氯化铁能和铜反应,方程式是2Fe3++Cu=2Fe2++Cu2+。
(4)镁是活泼的金属,能在CO2中燃烧,所以现象是 镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳。
(5)①由于镁和铝都是活泼的金属,极易被氧化,所以通入氩气的目的是隔绝空气,防止镁和铝被氧气氧化。
②1mol E17C12中含有17mol镁和12mol铝,其中17mol镁能生成17mol氢气,而12mol铝能生成18mol氢气。由于还吸收铝17mol氢气,所以最终放出的氢气是52mol。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案


