题目内容
【题目】溴化钙具有易溶于水、易吸潮等性质。溴化钙可用作阻燃剂、制冷剂,实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:

回答下列问题:
(1)上述使用的氢溴酸的物质的量浓度为0.5mol/L,若用1.0mol/L的氢溴酸配制0.5mol/L的氢溴酸500mL,所需的玻璃仪器有玻璃棒、______________________________。
(2)已知步骤III的滤液中不含NH4+。步骤II加入的试剂a是_________,控制溶液的pH约为8.0的目的是___________________、_________________。
(3)试剂b是___________,步骤IV的目的是__________________。
(4)步骤V所含的操作依次是___________、过滤。
(5)制得的溴化钙可以通过如下步骤测定其纯度:①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应;④__________;⑤_________;⑥____________。若得到1.88g碳酸钙,则溴化钙的质量分数为_________。 若实验操作规范而测定结果偏低,其原因是_____________。
【答案】量筒、烧杯、500mL容量瓶、胶头滴管氢氧化钙使铁离子、铝离子沉淀完全防止氢氧化铝溶解HBr除去过量的氢氧化钙蒸发浓缩,冷却结晶过滤洗涤烘干冷却94%CaBr2吸水
【解析】
大理石和氢溴酸反应生成溴化钙,因含有少量Al3+、Fe3+等杂质,可加入石灰水,沉淀Al3+、Fe3+,过滤后得到溴化钙、氢氧化钙的混合溶液,加入试剂b为氢溴酸,可除去过量的氢氧化钙,然后经蒸发浓缩、冷却结晶可得到溴化钙晶体。
(1)用浓溶液配制500mL 0.5mol/L的稀溶液,因此需要量筒取经过计算需要的浓溶液的体积,然后经过溶解、洗涤、转移、定容、摇匀等步骤,需要的玻璃仪器有玻璃棒、量筒、烧杯、500mL容量瓶、胶头滴管,故答案为:量筒、烧杯、500mL容量瓶、胶头滴管;
(2)加入的试剂a、控制溶液的pH约为8.0的目的是除去杂质Al3+、Fe3+,防止氢氧化铝溶解,因此a是碱,根据题意及不引入新的杂质可知是氢氧化钙,故答案为:氢氧化钙;确保Al3+、Fe3+沉淀完全;防止氢氧化铝溶解;
(3)加试剂b的目的是除去过量的氢氧化钙,且不引入新杂质,可以加入氢溴酸,故答案为:HBr;除去过量的氢氧化钙;
(4)步骤Ⅴ的结果是从溶液中得到CaBr26H2O,因此其操作步骤为蒸发浓缩,冷却结晶、过滤,故答案为:蒸发浓缩,冷却结晶;
(5)④溴化钙溶液中滴入足量Na2CO3溶液,产生沉淀碳酸钙,经过滤、洗涤、烘干冷却,再称量,
根据关系式CaBr2~CaCO3
200 100
3.76g 1.88g
故CaBr2的质量为3.76g,质量分数为=![]() ×100%=94%;溴化钙易吸水,因此造成测定结果偏低,故答案为:过滤、洗涤、烘干冷却;94%;溴化钙吸水。
×100%=94%;溴化钙易吸水,因此造成测定结果偏低,故答案为:过滤、洗涤、烘干冷却;94%;溴化钙吸水。

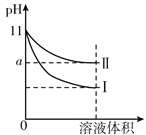
【题目】下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验① | 实验② | 实验③ |
|
|
|
A. 实验①中生成的沉淀是BaCO3
B. 实验①中有气体生成
C. 实验②沉淀中可能含有BaSO4
D. 实验③生成沉淀的离子方程式是:Ba2++ H2SO3===BaSO3↓+2H+
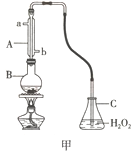
【题目】为探究 H2O2、SO2、Br2 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)
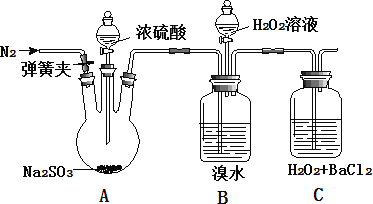
实验操作 | 实验现象 |
i. 打开 A 中分液漏斗活塞,滴加浓硫酸 | A 中有气泡产生,B 中红棕色褪色,C 中有白色沉淀 |
ii. 取 C 中沉淀加入盐酸 | C 中白色沉淀不溶解 |
iii. 打开B 中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加 H2O2 溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A 中发生反应的化学方程式是_____。
(2)B 中红棕色褪色的离子方程式是_____。
(3)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是_____。
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是_____。
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是_____。
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(4)iii 中滴入少量 H2O2 没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是_____。
(5)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是_____。