题目内容
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。设计方案如下:
(1)用图甲装置(加持装置略)蒸馏并收集馏分SO2,实验时B中加入100.00mL葡萄酒样品和适量盐酸,加热使SO2全部逸出,在C中收集馏分。
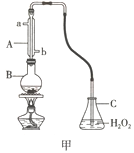
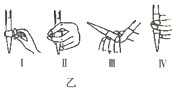
①若C中盛装H2O2溶液,则SO2与其完全反应的化学方程式为_________________________。除去C中过量的H2O2,然后用0.04000mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图乙中的_________(填序号)
②滴定至终点消耗NaOH溶液25.00mL,据此计算葡萄酒中SO2含量为____________g/L。
(2)由于蒸馏时盐酸易挥发,该测定结果比实际值偏高,因此改进实验方案时可将盐酸改为稀硫酸,或者采取以下措施:
①将图甲装置C中盛装的液体改为H2O,且馏分无挥发,改用0.01000 mol/L 标准I2溶液滴定,反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI,可选择________作指示剂,滴定终点的现象是_____________。
②盐酸虽然对此实验无干扰,但由于在上述实验过程中,存在空气的氧化作用,会使测定结果___________(填“偏高”“偏低”或“不变”)。
【答案】H2O2+SO2=H2SO4 III0.32淀粉溶液当最后一滴I2溶液滴下,溶液由无色变为蓝色,且30秒内不变色偏低
【解析】
(1)①双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用Ⅲ的方法;故答案为:SO2+H2O2=H2SO4;Ⅲ;
②根据2NaOH~H2SO4~SO2可知SO2的质量为:![]() ×(0.0400mol/L×0.025L)×64g/mol=0.032g,该葡萄酒中的二氧化硫含量为:
×(0.0400mol/L×0.025L)×64g/mol=0.032g,该葡萄酒中的二氧化硫含量为:![]() =0.32g/L,故答案为:0.32;
=0.32g/L,故答案为:0.32;
(2)①改用0.01000molL-1标准I2溶液滴定,选择淀粉溶液做指示剂,滴定终点的现象是:滴入最后一滴溶液变蓝色半分钟不变化证明反应达到终点,故答案为:淀粉溶液;当最后一滴I2溶液滴下,溶液由无色变为蓝色,且30秒内不变色;
②由于在上述实验过程中,存在空气的氧化作用,部分二氧化硫被氧化,使得消耗的标准溶液体积减小,测定结果偏低,故答案为:偏低。