题目内容
根据如图的装置进行实验回答下列问题:
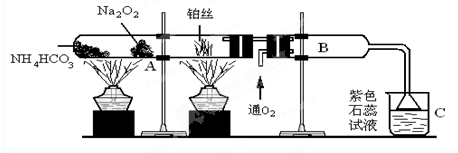
(1)在受热的试管中,写出A处的Na2O2发生反应的化学方程式:
①
(2)被加热的铂丝处发生反应的化学方程式:
(3)B管内出现的现象:
(4)烧杯C中所发生的现象:
(5)B、C中可能发生的主要反应方程式:

(1)在受热的试管中,写出A处的Na2O2发生反应的化学方程式:
①
2CO2+2Na2O2=2Na2CO3+O2
2CO2+2Na2O2=2Na2CO3+O2
,②2H2O+2Na2O2=4NaOH+O2↑,
2H2O+2Na2O2=4NaOH+O2↑,
.(2)被加热的铂丝处发生反应的化学方程式:
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;
| ||
| △ |
(3)B管内出现的现象:
无色气体变成红棕色
无色气体变成红棕色
;(4)烧杯C中所发生的现象:
溶液变红色
溶液变红色
;(5)B、C中可能发生的主要反应方程式:
2NO+O2=2NO2
2NO+O2=2NO2
;3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.分析:加热碳酸氢铵时,碳酸氢铵分解生成二氧化碳、水和氨气,二氧化碳、水都能和过氧化钠反应生成氧气,氧气和氨气在铂丝作催化剂条件下能发生氧化还原反应生成一氧化氮和水,一氧化氮和氧气反应生成红棕色气体二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,石蕊试液遇酸变红色.
解答:解:(1)加热碳酸氢铵时,碳酸氢铵分解生成二氧化碳、水和氨气,二氧化碳、水都能和过氧化钠反应生成氧气,二氧化碳、水和过氧化钠反应方程式分别为:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2↑,故答案为:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2↑;
(2)在铂丝作催化剂、加热条件下,氨气和氧气发生氧化还原反应生成一氧化氮和水,反应方程式为:
4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(3)一氧化氮和氧气是无色气体,一氧化氮和氧气反应生成红棕色的二氧化氮,反应方程式为:2NO+O2=2NO2,所以看到的现象是:无色气体变成红棕色,故答案为:无色气体变成红棕色;
(4)氧化氮和水反应生成硝酸和一氧化氮,石蕊试液遇酸变红色,所以C中液体变红色,故答案为:溶液变红色;
(5)B、C中发生的化学反应是:2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,
故答案为:2NO+O2=2NO2,3NO2+H2O=2HNO3+NO.
(2)在铂丝作催化剂、加热条件下,氨气和氧气发生氧化还原反应生成一氧化氮和水,反应方程式为:
4NH3+5O2
| ||
| △ |
| ||
| △ |
(3)一氧化氮和氧气是无色气体,一氧化氮和氧气反应生成红棕色的二氧化氮,反应方程式为:2NO+O2=2NO2,所以看到的现象是:无色气体变成红棕色,故答案为:无色气体变成红棕色;
(4)氧化氮和水反应生成硝酸和一氧化氮,石蕊试液遇酸变红色,所以C中液体变红色,故答案为:溶液变红色;
(5)B、C中发生的化学反应是:2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,
故答案为:2NO+O2=2NO2,3NO2+H2O=2HNO3+NO.
点评:本题考查了物质间的反应,明确物质的性质是解本题关键,会用化学语言描述实验现象,为易错点.

练习册系列答案
相关题目
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.
(1)甲同学研究的实验报告如下表:
该同学的实验目的是研究______对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持______相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图1装置进行定量实验.完成该实验应选用的实验药品是Mg(或Fe)和______ (从给出的药品去选);应该测定的实验数据是______.
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(3)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是______的影响.
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是______
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.

(1)甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快. |
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图1装置进行定量实验.完成该实验应选用的实验药品是Mg(或Fe)和______ (从给出的药品去选);应该测定的实验数据是______.
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(3)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是______的影响.
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是______
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.

 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.