题目内容
【题目】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染和温室效应。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)== =4NO(g)+CO2(g)+2H2O(g) ΔH1=574kJ·mol1
CH4(g)+4NO(g)== =2N2(g)+CO2(g)+2H2O(g) ΔH2=1160kJ·mol1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ (CH3OH)与反应温度T的关系曲线如图所示,则上述反应的ΔH3 0(填“>”、“<”或“=”)。

②在一个恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
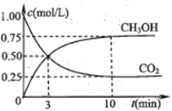
试回答:0~10 min内,氢气的平均反应速率为 mol·L1·min1;该温度下,反应的平衡常数的值为 (结果保留一位小数);第10min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数 (填“增大”、“减小”或“不变”)。
(3)脱硫。
①某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设参与反应的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为 。
②硫酸铵和硝酸铵的水溶液pH<7,其原因用离子方程式表示为 ;
在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中:c(Na+)+c(H+) c(NO3)+c(OH)(填“>”、“<”或“=”)。
【答案】(除注明外,每空2分)
(1) CH4(g)+2NO2(g) ===N2(g)+CO2(g)+2H2O(g) ΔH=867 kJ·mol1
(2)①<(1分) ②0.225 5.3 增大(1分)
(3)①12NH3+3O2+4SO2+4NO2+6H2O===4(NH4)2SO4+4NH4NO3
②NH4++H2O![]() NH3·H2O+H+ <(1分)
NH3·H2O+H+ <(1分)
【解析】
试题分析:
(1)已知:CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(g) ΔH1=574 kJ·mol1
CH4(g)+4NO(g) ===2N2(g)+CO2(g)+2H2O(g) ΔH2=1160 kJ·mol1
根据盖斯定律,两式相加除以2即得相应的热化学方程式:
CH4(g)+2NO2(g) ===N2(g)+CO2(g)+2H2O(g) ΔH=867 kJ·mol1。
(2)①五份混合气体组成相同、体积相等,分别加入温度不同、容积相同的恒容密闭容器中发生反应,反应相同时间后,测得甲醇的体积分数φ (CH3OH)不相等,因反应速率随温度升高而增大,所以图像中最高点时反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,说明升高温度平衡向逆反应方向进行,根据平衡移动规律可判断逆反应为吸热反应,则正反应为放热反应,故ΔH3<0。
②初始浓度c(CO2)=1.0 mol·L1,由图像可知,0~10 min内,氢气的平均反应速率为v(H2)=3v(CO2)= ![]() =0.225 mol·L1·min1;反应是按化学方程式计量数投料的,已知平衡时c(CO2)=0.25 kJ·mol1,则c(H2)=0.75 kJ·mol1,又已知c(CH3OH)= c(H2O)=0.75kJ·mol1,则平衡常数
=0.225 mol·L1·min1;反应是按化学方程式计量数投料的,已知平衡时c(CO2)=0.25 kJ·mol1,则c(H2)=0.75 kJ·mol1,又已知c(CH3OH)= c(H2O)=0.75kJ·mol1,则平衡常数![]() ;第10 min后,向该容器中再充入1 mol CO2和3 mol H2的操作可设计为两步完成,首先将容器体积扩大为原来的2倍,充入1 mol CO2和3 mol H2,达到的平衡状态与原平衡等效,CH3OH(g)的体积分数不变,为满足题给条件,需进行第二步操作即将容器压缩为原来的体积,此时由于压强增大,平衡向正反应移动,再次达到平衡时,气体总的物质的量减小,而CH3OH的物质的量增大,所以甲醇的体积分数φ (CH3OH)增大。
;第10 min后,向该容器中再充入1 mol CO2和3 mol H2的操作可设计为两步完成,首先将容器体积扩大为原来的2倍,充入1 mol CO2和3 mol H2,达到的平衡状态与原平衡等效,CH3OH(g)的体积分数不变,为满足题给条件,需进行第二步操作即将容器压缩为原来的体积,此时由于压强增大,平衡向正反应移动,再次达到平衡时,气体总的物质的量减小,而CH3OH的物质的量增大,所以甲醇的体积分数φ (CH3OH)增大。
(3)①已知反应物为SO2、NO2、NH3、O2,且SO2、NO2的物质的量之比为1∶1,生成物为两种氮肥(NH4)2SO4和NH4NO3,反应可表示为NH3+O2+SO2+NO2→(NH4)2SO4+NH4NO3,根据化合价升降进行配平,注意SO2与NO2的物质的量相等,配平时在反应物中补上水分子即得该反应的化学方程式:12NH3+3O2+4SO2+4NO2+6H2O===4(NH4)2SO4+4NH4NO3。
②硫酸铵和硝酸铵的水溶液pH<7,是由NH4+水解引起的,反应的离子方程式为![]() +H2O
+H2O![]() NH3·H2O+H+;硝酸铵与NaOH反应后的混合溶液中,根据电荷守恒有:c(Na+)+c(H+)+c(NH4+) =c(
NH3·H2O+H+;硝酸铵与NaOH反应后的混合溶液中,根据电荷守恒有:c(Na+)+c(H+)+c(NH4+) =c(![]() )+c(OH),c(
)+c(OH),c(![]() )>0,所以c(Na+)+c(H+)<c(
)>0,所以c(Na+)+c(H+)<c(![]() )+c(OH)。
)+c(OH)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案