题目内容
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
______________________________________________________________。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。

①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至 后,迅速关闭K1,观察到U形管内的现象是____________________________________________________。
②装置Ⅲ中发生反应的化学方程式为_______________________________。
③蘸NaOH溶液的棉花团的作用是___________________________________。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO__________________________________________________。
(1)4NO2+O2+2H2O=4HNO3(或分成两个方程式写)
(2)①U形管右侧胶塞下沿 U形管左端液面高于右端,铜丝慢慢溶解,产生无色气体,溶液逐渐变蓝(至少答三点) ②2H2O2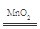 2H2O+O2↑
2H2O+O2↑
③吸收氮的氧化物防止污染环境
④再打开K3,若观察到长玻璃管中气体迅速变为红棕色,则证明余气含NO,若无颜色变化,则证明不含NO(其他合理答案也可)
【解析】
试题分析:根据实验目的和所放置的试剂可以推断,Ⅰ装置的作用是制备NO,Ⅲ装置的作用是制备O2,Ⅱ装置的作用是证明NO也可以与氧气和水共同作用生成HNO3。
(1)NO2经多次氧化、用水吸收的循环操作,充分转化为硝酸的化学方程式为4NO2+O2+2H2O=4HNO3。
(2)①注入稀硝酸应至U形管右侧胶塞下沿,迅速关闭K1后,U形管左端液面高于右端,铜丝慢慢溶解,产生无色气体,溶液逐渐变蓝。
②装置Ⅲ中发生反应的化学方程式为:2H2O2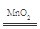 2H2O+O2↑。
2H2O+O2↑。
③蘸NaOH溶液的棉花团的作用是吸收氮的氧化物,防止污染环境。
④再打开K3,若观察到长玻璃管中气体迅速变为红棕色,则证明余气含NO,若无颜色变化,则证明不含NO。
考点:本题考查实验装置和实验方案的分析、反应现象的描述、化学方程式的书写。

 HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的.
HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸.
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸.