题目内容
 HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的.
HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的.(1)工业上用水吸收NO2生产硝酸,生成的尾气经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失).
①试写出上述反应的化学方程式
②设循环操作的次数为n次,试写出NO2→HNO3转化率a与循环次数n之间关系的数学关系式.
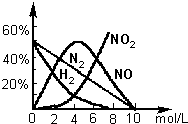
(2)用上述方法制备的HNO3为稀HNO3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3.实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物.例如镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液液中有Mg(NO3)2、NH4NO3和H2O.生成这些产物的HNO3浓度范围为:H2:c<6.6mol/L;N2和NH4+:c<10.0mol/L;NO:0.10mol/L<c<10.0mol/L;NO2:c>2.0mol/L.各气体产物成分及含量随HNO3的浓度变化曲线如图所示.
①写出Mg与12mol/L的HNO3反应的化学方程式
②480mg Mg与0.50L 4.0mol/L的HNO3充分反应,收集到112mL气体(SPT).试通过计算写出反应化学方程式.
分析:(1)①NO2与水反应生成HNO3和NO,又NO能被O2氧化为NO2;
②设起始时NO2物质的量为1 mol,经过n次循环后生成HNO3的物质的量为:Sn=
+
×
+
×(
)2+
×(
)3+??????+
×(
)nn-1,经等比数列求和可得,再根据转化率公式求算出转化率a与循环次数n之间关系;
(2)①根据图象可知当硝酸浓度大于10.0mol/L时,气体产物只有NO2,根据得失电子守恒和原子守恒写出方程式;
②480mg Mg与0.50L 4.0mol/L的HNO3充分反应,Mg的物质的量比较少,反应中硝酸过量,由图象可知:n(NO):n(N2):n(NO2):n(H2)=5:3:1:1,同时还原产物还有NH4+,根据Mg失去电子总数与气体得到电子数之差,求出NH4+的量,再通过原子守恒配平方程.
②设起始时NO2物质的量为1 mol,经过n次循环后生成HNO3的物质的量为:Sn=
| 2 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
(2)①根据图象可知当硝酸浓度大于10.0mol/L时,气体产物只有NO2,根据得失电子守恒和原子守恒写出方程式;
②480mg Mg与0.50L 4.0mol/L的HNO3充分反应,Mg的物质的量比较少,反应中硝酸过量,由图象可知:n(NO):n(N2):n(NO2):n(H2)=5:3:1:1,同时还原产物还有NH4+,根据Mg失去电子总数与气体得到电子数之差,求出NH4+的量,再通过原子守恒配平方程.
解答:解:(1)①NO2与水反应生成HNO3和NO,又NO能被O2氧化为NO2;所以上述反应的化学方程式为3NO2+H2O=2HNO3+NO,2NO+O2=2NO2;
故答案为:3NO2+H2O=2HNO3+NO,2NO+O2=2NO2;
②设起始时NO2物质的量为1 mol,经过nn次循环后生成HNO3的物质的量为:Sn=
+
×
+
×(
)2+
×(
)3+??????+
×(
)nn-1,经等比数列求和可得:Sn=1-(
)nn,则NO2生成HNO3转化率为:
=a,即a=1-(
)nn;
故答案为:a=1-(
)nn;
(2)①根据图象可知当硝酸浓度大于10.0mol/L时,气体产物只有NO2,Mg+HNO3→Mg(NO3)2+NO2↑+H2O,反应中HNO3→NO2,N元素从+5价降到+4价得到1个电子,
Mg→Mg(NO3)2,Mg元素从0价升到+2价失去2个电子,所以Mg的计量数为1,NO2的计量数为2,再根据原子守恒配平:Mg+4HNO3=Mg(NO3)2+2NO2↑+2H2O;
故答案为:Mg+4HNO3=Mg(NO3)2+2NO2↑+2H2O;
②480mg Mg与0.50L 4.0mol/L的HNO3充分反应,Mg的物质的量比较少为0.02mol,HNO3的物质的量为2mol,反应中硝酸过量,
由图象可知:nn(NO):nn(N2):n(NO2):n(H2)=5:3:1:1,同时还原产物还有NH4+,
0.02molMg失去电子为0.04mol,反应生成气体为n=0.005mol,其中nn(NO)=0.005mol×
=0.0025mol,nn(N2)=0.0015mol,n(NO2)=0.0005mol,
n(H2)=0.0005mol,则气体得到电子数为0.0025mol×3+0.0015mol×5×2+0.0005mol×1+0.0005mol×2=0.024mol,
则生成NH4+时N元素得到的电子为0.04mol-0.024mol=0.016,所以生成NH4+的量为0.016×
=0.002mol,
所以n(NO):nn(N2):n(NO2):n(H2):n(NH4+):n(Mg)=5:3:1:1:4:40,
所以NO、N2、NO2、H2、NH4NO3、Mg的计量数分别为5、3、1、1、4、40,再由原子守恒得方程为:40Mg+100HNO3=5NO↑+3N2↑+H2↑+NO2↑+4NH4NO3+40Mg(NO3)2+41H2O;
故答案为:40Mg+100HNO3=5NO↑+3N2↑+H2↑+NO2↑+4NH4NO3+40Mg(NO3)2+41H2O.
故答案为:3NO2+H2O=2HNO3+NO,2NO+O2=2NO2;
②设起始时NO2物质的量为1 mol,经过nn次循环后生成HNO3的物质的量为:Sn=
| 2 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
1-(
| ||
| 1 |
| 1 |
| 3 |
故答案为:a=1-(
| 1 |
| 3 |
(2)①根据图象可知当硝酸浓度大于10.0mol/L时,气体产物只有NO2,Mg+HNO3→Mg(NO3)2+NO2↑+H2O,反应中HNO3→NO2,N元素从+5价降到+4价得到1个电子,
Mg→Mg(NO3)2,Mg元素从0价升到+2价失去2个电子,所以Mg的计量数为1,NO2的计量数为2,再根据原子守恒配平:Mg+4HNO3=Mg(NO3)2+2NO2↑+2H2O;
故答案为:Mg+4HNO3=Mg(NO3)2+2NO2↑+2H2O;
②480mg Mg与0.50L 4.0mol/L的HNO3充分反应,Mg的物质的量比较少为0.02mol,HNO3的物质的量为2mol,反应中硝酸过量,
由图象可知:nn(NO):nn(N2):n(NO2):n(H2)=5:3:1:1,同时还原产物还有NH4+,
0.02molMg失去电子为0.04mol,反应生成气体为n=0.005mol,其中nn(NO)=0.005mol×
| 5 |
| 10 |
n(H2)=0.0005mol,则气体得到电子数为0.0025mol×3+0.0015mol×5×2+0.0005mol×1+0.0005mol×2=0.024mol,
则生成NH4+时N元素得到的电子为0.04mol-0.024mol=0.016,所以生成NH4+的量为0.016×
| 1 |
| 8 |
所以n(NO):nn(N2):n(NO2):n(H2):n(NH4+):n(Mg)=5:3:1:1:4:40,
所以NO、N2、NO2、H2、NH4NO3、Mg的计量数分别为5、3、1、1、4、40,再由原子守恒得方程为:40Mg+100HNO3=5NO↑+3N2↑+H2↑+NO2↑+4NH4NO3+40Mg(NO3)2+41H2O;
故答案为:40Mg+100HNO3=5NO↑+3N2↑+H2↑+NO2↑+4NH4NO3+40Mg(NO3)2+41H2O.
点评:本题考查了二氧化氮与水制备硝酸的反应,氧化还原方程式的配平等,题目难度很大,要求学生对氧化还原反应掌握比较深入,同时有比较好的数学功底.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸.
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸.
