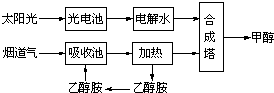
题目内容
科学家利用Na2CO3溶液喷淋捕捉空气中CO2,设计技术流程如图1:

请回答下列问题:
(1)Na2CO3溶液喷成雾状的目的是____ 。
(2)在500℃的反应炉中发生反应的化学方程式为 。
(3)在整个流程中,可以循环利用的物质是 。
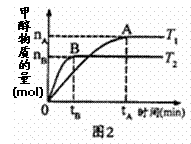 (4)为研究合成塔反应最佳条件,在10 L密闭
(4)为研究合成塔反应最佳条件,在10 L密闭
容器中发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①对于图2实验结果(注:T1、T2均大于300℃)
说法正确的是__________(填序号)。
a.向密闭容器中不断补充CO2,H2转化率增大
b.该反应在T1时的平衡常数比T2时小
c.温度为T1时,从反应开始到平衡,H2平均速率为![]()
d.平衡处于A点时密闭容器温度从T1变到T2,![]() 增大
增大
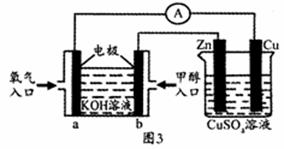 ②300℃时,若充人1 mol CO2和
②300℃时,若充人1 mol CO2和
3 mol H2,从反应开始到平衡,测得CO2的转化率为75%。则平衡常数K为
(用最简分数表示)。
(5)将制备的甲醇(CH3OH)用于图3装置,其中b电极上发生反应的电极反应式为 ;
当铜片质量变化19.2 g时,a极上消耗的O2在标准状况下的体积为__ _L。
(1)使反应充份发生或提高反应速率(2分)
(2)2NaHCO3![]() Na2CO3+CO2↑+H2O(2分) (3)Na2CO3或碳酸钠(2分)
Na2CO3+CO2↑+H2O(2分) (3)Na2CO3或碳酸钠(2分)
(4)①ad(2分) ②1600/3(2分)
(5)CH3OH-6e—+8OH—===CO32—+6H2O(2分); 3.36(2分)

 全能练考卷系列答案
全能练考卷系列答案
| Zn的质量/g | Zn的形状 | 温度/℃ | 溶于酸的时间/s |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 45 | 25 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
利用上述数据,完成下列问题:
(1)画出时间对温度的曲线图。
(2)利用所画的曲线图和上述实验数据,能得出关于温度影响反应速率的什么结论?
(3)对比数据B与F,解释F溶于酸那么快的原因。