题目内容
(10分)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
X |
X+具有与Ne原子相同的电子层结构 |
|
Y |
最外层电子数是次外层的一半,其最高正价与最低负价的绝对值相等 |
|
Z |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
T |
元素单质的颜色是黄绿色的气体 |
(1) Y在周期表中的位置是 ,Z的原子结构示意图是 。
(2) X元素与T元素形成化合物的电子式是 。
(3) X的最高价氧化物对应水化物的化学式是 ,化学键类型有 。
(4) Y和Z的最高价氧化物对应的水化物中酸性较强的是 (填化学式)
写出可以验证该结论的一个简单易行的实验方案
。
(1)第3周期第ⅣA族(2分), 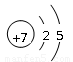 (1分)
(1分)
(2) (1分)
(1分)
(3)NaOH,离子键、极性共价键 (各1分)
(4)HNO3(1分),向Na2SiO3溶液中滴加HNO3溶液,产生白色沉淀。(2分)
【解析】X+具有与Ne原子相同的电子层结构,则X是Na。最高正价与最低负价的绝对值相等,说明属于第ⅣA,又因为最外层电子数是次外层的一半,所以Y是Si。氢化物水溶液呈碱性只有氨气,所以Z是N。单质的颜色是黄绿色的气体的是氯气,则T是Cl。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间形成共价键。所以氯化钠中含有的是离子键,氢氧化钠中含有离子键和极性键。根据元素周期律可判断,N的非金属性强于Si,所以硝酸的酸性强于硅酸的,可以利用较强的酸来制取较弱的酸来验证。

 阅读快车系列答案
阅读快车系列答案





 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-