题目内容
某实验兴趣小组拟选用如图装置测定SO2转化为SO3的转化率.各装置可重复使用.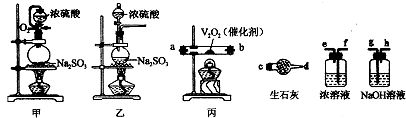
(1)制备SO2时选用的是甲装置而不是乙装置的原因除了考虑要将生成的气体排出外,还考虑的原因是
(2)请选择必要的装置,按气流方向连接顺序是:甲中出来的气体→
(3)根据实验装置进行实验,实验步骤如下:
①
②装入药品;
③
④滴入浓硫酸;
⑤实验中,当V2O5表面红热时,应将酒精灯移开一会儿再加热,这样做的原因是
⑥实验结束后,称量相应装置的质量变化(m1为浓硫酸吸收SO3的质量增重,m2为生石灰吸收SO2的质量增重).
(4)利用(3)所得的相关数据,计算出SO2的转化率
分析:(1)据装置特点对比得出甲装置的优点,亚硫酸钠可以和浓硫酸反应生成二氧化硫;
(2)可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,较低,可以用冰水来获得三氧化硫,可以用碱石灰或者氢氧化钠溶液进行尾气处理;
(3)根据实验目的结合试验装置选择合适的实验步骤;
(4)二氧化硫的转化率=
×100%,根据硫元素守恒结合三氧化硫的量确定二氧化硫的变化量.
(2)可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,较低,可以用冰水来获得三氧化硫,可以用碱石灰或者氢氧化钠溶液进行尾气处理;
(3)根据实验目的结合试验装置选择合适的实验步骤;
(4)二氧化硫的转化率=
| 二氧化硫的变化量 |
| 二氧化硫的初始总量 |
解答:解:(1)据装置特点对比得出甲装置的优点:甲装置可以将二氧化硫和氧气充分混合并且采用弯导管可以便于浓硫酸顺利滴下,亚硫酸钠可以和浓硫酸反应生成二氧化硫,即Na2SO3(s)+H2SO4(浓)═Na2SO4+SO2↑+H2O,
故答案为:甲装置可以将二氧化硫和氧气充分混合(采用弯导管可以便于浓硫酸顺利滴下);Na2SO3(s)+H2SO4(浓)═Na2SO4+SO2↑+H2O;
(2)可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16.8℃,较低,可以用生石灰来获得三氧化硫,可以用碱石灰或者氢氧化钠溶液进行尾气处理,二氧化硫在转化为三氧化硫之前要进行干燥,故答案为:f、e→a、b(或b、a)→f、e→c、d;
(3)根据实验目的结合试验装置,首先要进行装置气密性的检查,然后装药品,并加入催化剂,最用加入浓硫酸,反应开始发生,根据二氧化硫转化为三氧化硫的反应:2SO2+O?2SO3,△H<0,可知道,温度过高不利于二氧化硫的转化,且催化剂的活性受到温度的限制,
故答案为:检查装置的气密性;加热催化剂;温度过高不利于二氧化硫的生成且影响催化剂的催化活性;
(4)二氧化硫的转化率=
×100%,m1为浓硫酸吸收SO3的质量增重,当生成m1的三氧化硫时,消耗的二氧化硫的质量是0.8m1,m2为生石灰吸收SO2的质量增重,即剩余的二氧化硫的质量,所以二氧化硫的转化率=
×100%,
故答案为:
×100%.
故答案为:甲装置可以将二氧化硫和氧气充分混合(采用弯导管可以便于浓硫酸顺利滴下);Na2SO3(s)+H2SO4(浓)═Na2SO4+SO2↑+H2O;
(2)可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16.8℃,较低,可以用生石灰来获得三氧化硫,可以用碱石灰或者氢氧化钠溶液进行尾气处理,二氧化硫在转化为三氧化硫之前要进行干燥,故答案为:f、e→a、b(或b、a)→f、e→c、d;
(3)根据实验目的结合试验装置,首先要进行装置气密性的检查,然后装药品,并加入催化剂,最用加入浓硫酸,反应开始发生,根据二氧化硫转化为三氧化硫的反应:2SO2+O?2SO3,△H<0,可知道,温度过高不利于二氧化硫的转化,且催化剂的活性受到温度的限制,
故答案为:检查装置的气密性;加热催化剂;温度过高不利于二氧化硫的生成且影响催化剂的催化活性;
(4)二氧化硫的转化率=
| 二氧化硫的变化量 |
| 二氧化硫的初始总量 |
| 0.8m1 |
| 0.8m1+m2 |
故答案为:
| 0.8m1 |
| 0.8m1+m2 |
点评:本题是一道实验方案设计题目,考查学生分析和解决问题的能力,综合性强,难度大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
超氧化钾(KO2)又称为化学氧自救剂,容易与空气中的水、二氧化碳等发生反应,主要用于煤矿井下急救.某兴趣小组拟选用如下装置制备超氧化钾(部分夹持仪器已略去).
请回答下列问题:
(1)请选择必要的装置,按气流方向的连接顺序为 (填仪器接口的字母).
(2)请根据完整的实验装置,完成下列实验步骤:① ;②装入药品,打开分液漏斗活塞;③持续通入气体一段时间后,点燃酒精灯进行反应;④反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;⑤拆除装置,取出产物.
(3)数据记录如下:
根据数据计算可得实验式KOx,则x= .
(4)超氧化钾可吸收二氧化碳,并生成氧气,因此可以作为飞船、潜艇等密闭系统的氧气再生剂.写出超氧化钾与二氧化碳反应的化学方程式: .与过氧化钠相比,其优点是 .

请回答下列问题:
(1)请选择必要的装置,按气流方向的连接顺序为
(2)请根据完整的实验装置,完成下列实验步骤:①
(3)数据记录如下:
| 空陶瓷管的质量 | 陶瓷管与钾的总质量 | 陶瓷管与产物的总质量 |
| 14.80g | 15.19g | 15.47g |
(4)超氧化钾可吸收二氧化碳,并生成氧气,因此可以作为飞船、潜艇等密闭系统的氧气再生剂.写出超氧化钾与二氧化碳反应的化学方程式: