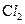题目内容
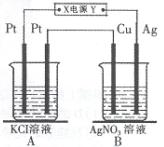
如右图所示,常温下电解5 min后,铜电极质量增加2.16g。
试回答:
(1)电源电极X名称为 (填“正极”或“负极”),B中 铜电极的名称 。
(2)电解池B中阳极的电极反应式是 。
(3)若A中KCl溶液的体积是200mL,电解后溶液的
PH= (忽略电解前后溶液体积的变化)。
若要使电解后的溶液恢复到与电解前完全相同,应
加入 。

试回答:
(1)电源电极X名称为 (填“正极”或“负极”),B中 铜电极的名称 。
(2)电解池B中阳极的电极反应式是 。
(3)若A中KCl溶液的体积是200mL,电解后溶液的
PH= (忽略电解前后溶液体积的变化)。
若要使电解后的溶液恢复到与电解前完全相同,应
加入 。
(1)负极,阴极(2)Ag++e-="Ag " (3)13 ,HCl
(1)据题意铜电极质量增加,可说明银离子在此电极上析出,可推出铜电极是阴极,进一步推
出X的电极为负极。
(2)银电极为阳极,由于银为活性电极,故银本身失电子。
(3) 据B中阴极电极反应式:Ag++ e- =" Ag" ,显然当析出银的物质的量为0.02mol时,电子转移0.02mol,由A与B两池中转移电子式相等,结合电解KCl溶液的总反应式:2Cl-+2H2O C12↑+ H2↑+ 2OH-,可推出OH-的物质的量等于转移电子的物质的量,即n(OH-)为0.02mol,c(OH-)=0.1mol,由水的离子积常数随之推出c(H+) ,随之求解PH。要使电解后的溶液恢复到与电解前完全相同,其规律是加入将从电极上析出的单质通过化合反应生成的物质即可复原。
C12↑+ H2↑+ 2OH-,可推出OH-的物质的量等于转移电子的物质的量,即n(OH-)为0.02mol,c(OH-)=0.1mol,由水的离子积常数随之推出c(H+) ,随之求解PH。要使电解后的溶液恢复到与电解前完全相同,其规律是加入将从电极上析出的单质通过化合反应生成的物质即可复原。
出X的电极为负极。
(2)银电极为阳极,由于银为活性电极,故银本身失电子。
(3) 据B中阴极电极反应式:Ag++ e- =" Ag" ,显然当析出银的物质的量为0.02mol时,电子转移0.02mol,由A与B两池中转移电子式相等,结合电解KCl溶液的总反应式:2Cl-+2H2O
 C12↑+ H2↑+ 2OH-,可推出OH-的物质的量等于转移电子的物质的量,即n(OH-)为0.02mol,c(OH-)=0.1mol,由水的离子积常数随之推出c(H+) ,随之求解PH。要使电解后的溶液恢复到与电解前完全相同,其规律是加入将从电极上析出的单质通过化合反应生成的物质即可复原。
C12↑+ H2↑+ 2OH-,可推出OH-的物质的量等于转移电子的物质的量,即n(OH-)为0.02mol,c(OH-)=0.1mol,由水的离子积常数随之推出c(H+) ,随之求解PH。要使电解后的溶液恢复到与电解前完全相同,其规律是加入将从电极上析出的单质通过化合反应生成的物质即可复原。
练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
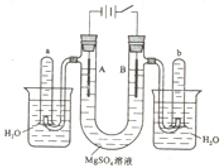
 KCl + Na NaCl + K + Q (Q<0)
KCl + Na NaCl + K + Q (Q<0)
 Na2Sx,以下说法正确的是
Na2Sx,以下说法正确的是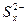
 xS+2e-
xS+2e-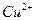
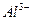
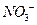
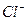
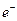 通过时(忽略电解时溶液体积的变化及电
通过时(忽略电解时溶液体积的变化及电