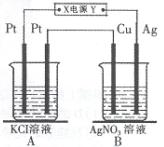
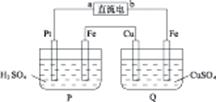
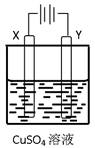
题目内容
β′Al2O3陶瓷作固体电解质,反应式如下:2Na+xS Na2Sx,以下说法正确的是
Na2Sx,以下说法正确的是
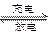 Na2Sx,以下说法正确的是
Na2Sx,以下说法正确的是| A.放电时,Na作正极,S极发生还原反应 |
| B.若用此电池电解硝酸银溶液,当阴极上产生标准状况下气体1.12 L时,消耗金属钠2.3 g |
| C.充电时,钠极与外电源的正极相连 |
D.充电时,阳极发生的反应为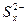  xS+2e- xS+2e- |
D
作为充电电池,当其充电时,相当于电解池;放电时,为原电池。已知原电池负极发生的是氧化反应(即元素价态升高),正极发生的是还原反应(元素价态降低);电解池中,阴极发生还原反应(元素价态降低),阳极发生的是氧化反应(元素价态升高)。由此分析A项中,Na为负极,故错误。B项据电子守恒及离子放电顺序知,电解时阳极产生的气体为O2,转移电子的物质的量为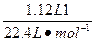 ×4="0.2" mol;故消耗Na也应为0.2 mol,即4.6 g,故B项也错误。充电时,钠极应与外电源的负极相连,故C项错误。
×4="0.2" mol;故消耗Na也应为0.2 mol,即4.6 g,故B项也错误。充电时,钠极应与外电源的负极相连,故C项错误。
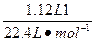 ×4="0.2" mol;故消耗Na也应为0.2 mol,即4.6 g,故B项也错误。充电时,钠极应与外电源的负极相连,故C项错误。
×4="0.2" mol;故消耗Na也应为0.2 mol,即4.6 g,故B项也错误。充电时,钠极应与外电源的负极相连,故C项错误。
练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目