题目内容
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
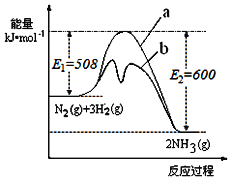
(1)根据如图提供的信息,写出该反应的热化学方程式___,如图的曲线中__(填“a”或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是___。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成nmolN2的同时生成2nmolNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)500℃、50MPa时,在容积为1L的容器中加入1molN2、3molH2,反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K=___。
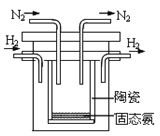
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式为___。
【答案】N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92kJ·mol-1 b BD
2NH3(g);ΔH=-92kJ·mol-1 b BD ![]() N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
【解析】
(1)根据图1计算出反应热,写出热化学方程式.注意物质状态,反应热符号等;催化剂能降低反应的活化能;
(2)根据平衡状态的判断依据判断;只要满足正反应速率等于逆反应速率,即可判断;
(3)根据“三行式”来进行计算得出结论;
(4)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,酸性条件下生成氨气。
(1)由图1可知,1molN2(g)与3molH2(g)完全反应生成2molNH3(g)的反应热为508kJ/mol-600kJ/mol=-92kJ/mol,所以合成氨的热化学反应方程式为N2(g)+3H2(g)![]() 2NH3(g) △H═-92kJ/mol,催化剂能降低反应的活化能,b活化能较低,故答案为b;
2NH3(g) △H═-92kJ/mol,催化剂能降低反应的活化能,b活化能较低,故答案为b;
(2)A.3υ(H2)正=2υ(NH3)逆说明:v(NH3)逆:v(H2)正═3:2不等于对应化学计量数之比,即正反应速率不等于逆反应速率,故A错误;
B.单位时间内生成nmolN2的同时生成2n molNH3说明正反应速率等于逆反应速率,故B正确;
C.体积不变,气体的质量不变,密度也会不变,用密度不变无法区分非平衡状态和平衡状态,故C错误;
D.反应N2(g)+3H2(g)![]() 2NH3(g)是反应前后气体的总物质的量不相等的反应,当体积固定时,根据阿伏伽德罗定律可知,温度、体积相同时,气体的物质的量之比等于压强之比,容器内气压不随时间变化,说明气体的总物质的量不再发生变化,即说明可逆反应达到了化学平衡状态,故D正确;
2NH3(g)是反应前后气体的总物质的量不相等的反应,当体积固定时,根据阿伏伽德罗定律可知,温度、体积相同时,气体的物质的量之比等于压强之比,容器内气压不随时间变化,说明气体的总物质的量不再发生变化,即说明可逆反应达到了化学平衡状态,故D正确;
故答案为BD;
(3)根据题意:N2(g)+3H2(g)2NH3(g)
初始物质的量浓度:1 3 0
变化物质的量浓度:a 3a 2a
平衡物质的量浓度:1-a 3-3a 2a
则平衡常数为K=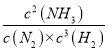 =
=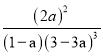 =
=![]() ;
;
(4)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,所以阴极反应为:N2+6H++6e-=2NH3。

 通城学典默写能手系列答案
通城学典默写能手系列答案