��Ŀ����
����Ŀ�����������е�18��Ԫ�ؾ�����Ҫ����;�����ִ���ҵ�б���������
��1������һ��Ӳ���࣬����ʴ��ǿ�Ľ����������ڵ�ƺ��������ָ֣���̬Crԭ���У�����ռ������ܲ�ķ���Ϊ___�����ܲ��Ͼ��е�ԭ�ӹ����Ϊ___��
��2����������Ԫ�صĵ�һ��������ԭ��������������������������ģ�30Zn��31Ga�ĵ�һ�������Ƿ������һ���ɣ�___����ǡ�����ԭ����______________�����ǰһ����ǡ������ʿ��Բ��𣩡�
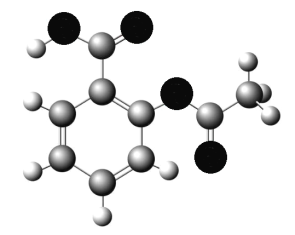
��3�������VA��Ԫ�ؿ��γɶ��������˹��뵼����ϣ��黯�أ�GaAs����������һ�֣��侧��ṹ����ͼ��ʾ����ɫ�����Asԭ�ӣ�����GaAs�����У�ÿ��Gaԭ����____��Asԭ����������ͬһ��Gaԭ��������Asԭ�ӹ��ɵĿռ乹��Ϊ_____��
��4����Asͬ����Ķ�����Ԫ����N��P��AsH3����ԭ���ӻ�������Ϊ____��һ��ѹǿ�½�AsH3��NH3��PH3�Ļ�����彵��ʱ����Һ������_______��������__________��
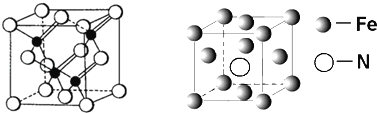
��5�����Ķ��ֻ������Ϊ���Բ��ϣ�������������һ�֣�ij�������ľ����ṹ��ͼ��ʾ�������Ļ�ѧʽΪ________���辧���߳�Ϊacm�������ӵ�����ΪNA���þ�����ܶ�Ϊ__g��cm��3���ú�a��NA��ʽ�ӱ�ʾ��
���𰸡�N 16 �� 30Zn��4s�ܼ���2�����ӣ�����ȫ��״̬�����ȶ� 4 �������� sp3 NH3 NH3����֮����������е�ϸ� Fe4N ![]() ��
��
��������
���⣨1�����ݸ���������Ų���֪����Ԫ���������N�㣬�ݴ˻ش�(2)30Zn��4s�ܼ���2�����ӣ�����ȫ��״̬�����ȶ���31Ga��4p�ܼ���1�����ӣ����ȶ���(3)���� GaAs�ľ����ṹͼ��֪��Asλ�ھ��������ĺͶ�����Gaλ����4��Asԭ�ӹ��ɵ���������������ݴ��жϣ�(4)��Asͬ�����Ԫ����N��P������AsH3�ĽṹӦ��NH3������NH3����֮����������е������(5)���ݾ�̯��ȷ���������Ļ�ѧʽ������![]() �����ܶȡ�
�����ܶȡ�
��������1�����ĺ�������Ų���1s22s22p63s23p63d54s1��ԭ����������������ߣ���Ԫ���������N�㣬���ܲ��Ϲ���spdf�ĸ��ܼ������е�ԭ�ӹ����Ϊ1+3+5+7=16��
(2)30Zn��4s�ܼ���2�����ӣ�����ȫ��״̬�����ȶ���31Ga��4p�ܼ���1�����ӣ����ȶ�������30Zn��31Ga�ĵ�һ�����ܲ�������ԭ������������һ������������Ĺ��ɣ�
(3)���� GaAs�ľ����ṹͼ��֪��Asλ�ھ��������ĺͶ�����Gaλ����4��Asԭ�ӹ��ɵ��������������ÿ��Gaԭ����4��Asԭ����������ͬһ��Gaԭ��������Asԭ�ӹ��ɵĿռ乹��Ϊ�������壻
(4)NH3��Nԭ�ӵ��ӻ���ʽ��![]() ��N��P��Asͬ���壬����AsH3�ĽṹӦ��NH3������AsH3��As���ӻ���ʽ��
��N��P��Asͬ���壬����AsH3�ĽṹӦ��NH3������AsH3��As���ӻ���ʽ��![]() ��NH3����֮����������е������һ��ѹǿ�½�AsH3��NH3��PH3�Ļ�����彵��ʱ����Һ������NH3��(5)���ݾ�̯����Nԭ��λ�ھ������ģ�����1��Nԭ�ӣ�Feԭ��λ�ڶ�������ģ�Fe����
��NH3����֮����������е������һ��ѹǿ�½�AsH3��NH3��PH3�Ļ�����彵��ʱ����Һ������NH3��(5)���ݾ�̯����Nԭ��λ�ھ������ģ�����1��Nԭ�ӣ�Feԭ��λ�ڶ�������ģ�Fe����![]() �����Ե�������ѧʽ��Fe4N�������߳�Ϊacm��һ�����������Ϊ
�����Ե�������ѧʽ��Fe4N�������߳�Ϊacm��һ�����������Ϊ![]() ��һ��������������
��һ��������������![]() ������
������![]() ���þ�����ܶ�Ϊ
���þ�����ܶ�Ϊ![]() g��cm��3��
g��cm��3��

 ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д� �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д�