题目内容
【题目】元素A位于第4周期,其基态原子有6个未成对电子;元素B的原子最外层电子数是其内层电子总数的3倍;元素C基态原子的3p轨道上有4个电子,元素D是有机物必不可少的中心元素,E是周期表中原子半径最小的元素。
(1)元素B与元素C可形成多种化合物。
①元素B与C中电负性较大的是______(填元素符号)。
②离子CB42—的空间构型为______(用文字描述)。
(2)B和E形成简单化合物的沸点大于C和E形成的简单化合物,其原因______。
(3)含A3+的溶液与NaCl、氨水反应可得到化合物Na[A(NH3)2Cl4]。
①基态A原子的电子排布式是______。
②1 mol配合物Na[A(NH3)2Cl4]中含σ键的数目为______mol。
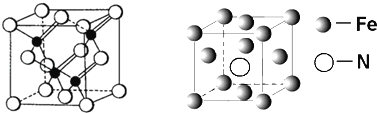
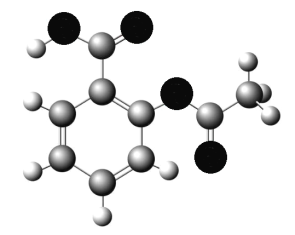
(4)下图为B、D、E三种元素形成的一种化合物的球棍模型,推测该化合物中D原子的杂化方式______。
【答案】O正四面体H2O分子间形成氢键[Ar]3d54s112sp2、sp3
【解析】
元素A位于第四周期,其基态原子有6个未成对电子,核外电子排布式为1s22s22p63s23p63d54s1,则A为Cr;元素B的原子最外层电子数是其内层电子总数的3倍则为氧元素;元素C基态原子的3p轨道上有4个电子则核外电子排布式为1s22s22p63s23p4,元素C为硫元素;元素D是有机物必不可少的中心元素则为碳元素,E是周期表中原子半径最小的元素则为氢元素。
(1)①元素B与C分别为O和S,非金属性越强电负性越大,故电负性较大的是O;
②离子CB42—为SO42-,根据价层电子对互斥理论,价层电子对个数=σ键+孤电子对个数,SO42-中中心原子S的价层电子对为![]() =4,孤电子对数为
=4,孤电子对数为![]() =0,不含孤电子对,所以空间构型是正四面体结构;
=0,不含孤电子对,所以空间构型是正四面体结构;
(2)B和E形成简单化合物H2O的沸点大于C和E形成的简单化合物H2S,其原因是H2O分子间形成氢键;
(3)含A3+的溶液与NaCl、氨水反应可得到化合物Na[Cr(NH3)2Cl4]。
①基态Cr原子的电子排布式是1s22s22p63s23p63d54s1或[Ar]3d54s1;
②单键即为σ键,1 mol配合物Na[Cr(NH3)2Cl4]中含σ键的数目为12mol;
(4)下图为B、D、E三种元素形成的一种化合物的球滚模型,推测该化合物为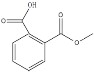 ,甲基中碳原子价层电子对个数=σ键个数+孤电子对个数=4+0=4,为sp3杂化,苯环中的碳原子、酯基中的碳原子价层电子对个数=σ键个数+孤电子对个数=3+0=3,为sp2杂化,故该化合物中D原子的杂化方式sp2、sp3。
,甲基中碳原子价层电子对个数=σ键个数+孤电子对个数=4+0=4,为sp3杂化,苯环中的碳原子、酯基中的碳原子价层电子对个数=σ键个数+孤电子对个数=3+0=3,为sp2杂化,故该化合物中D原子的杂化方式sp2、sp3。