题目内容
对于0.1 mol·L-1 Na2SO3溶液,正确的是( )
| A.升高温度,溶液的pH降低 |
| B.c(Na+)=2c(SO32―)+c(HSO3-)+c(H2SO3) |
| C.c(Na+)+c(H+)=2c(SO32―)+2c(HSO3-)+c(OH―) |
| D.加入少量NaOH固体,c(SO32―)与c(Na+)均增大 |
D
Na2SO3为弱酸强碱盐,水解显碱性,水解是吸热反应,所以温度升高,水解程度增大,其pH增大,故A不正确;B项考查物料守恒,正确的表达式为c(Na+)=2c(SO32―)+2c(HSO3-)+2c(H2SO3),故B不正确;C项是考查电荷守恒,其正确的表达式为c(Na+)+c(H+)=2c(SO32―)+c(HSO3-)+c(OH―),故C不正确;加入少量NaOH固体,抑制其水解,水解程度降低,c(SO32―)与c(Na+)均增大,故D正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
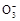 )+c(H+)>c(C
)+c(H+)>c(C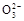 )
)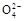 )>c(N
)>c(N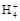 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)

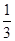 ,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。
,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。