题目内容
【题目】教材插图是对教材内容高度概括的体现,也是为说明、理解、深化文字内容服务的。请回答下列问题:
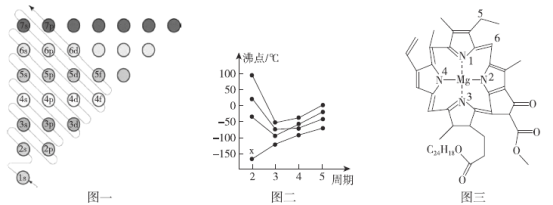
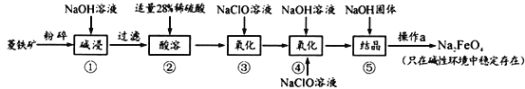
(1)图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有___种,其中原子序数最大的基态原子的外围电子排布式为___。
(2)图二中,每条折线代表周期表中IVA-VIIA某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为___;与x点对应的简单氢化物互为等电子体的离子为___(写一种)。
(3)图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与Mg2+形成的化学键类型为___;5号C原子和6号C原子的杂化方式分别为___、___;该分子中所含非金属元素的电负性由小到大的顺序为___。
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加德罗常数为NA,已知sin60°=![]() ),石墨晶体的密度为___g·cm-3(列出计算式)。
),石墨晶体的密度为___g·cm-3(列出计算式)。

【答案】3 3d104s1 x点对应的氢化物为CH4,另外三条曲线中第二周期对应的气态氢化物分别为NH3、H2O、HF,其分子间存在氢键,导致沸点反常升高 NH4+ 配位键 sp3 sp2 H<C<N<O 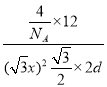
【解析】
(1)第四周期中,基态4s能级半充满的元素有K、Cr、Cu,共3种元素,其中原子序数最大为Cu,其基态原子的外围电子排布式为3d104s1;
故答案为:3;3d104s1;
(2)x点对应的氢化物为CH4,另外三条曲线中第二周期对应的气态氢化物分别为NH3、H2O、HF,其分子间存在氢键,导致沸点反常升高;与x点对应的简单氢化物互为等电子体的离子为NH4+;
故答案为:x点对应的氢化物为CH4,另外三条曲线中第二周期对应的气态氢化物分别为NH3、H2O、HF,其分子间存在氢键,导致沸点反常升高;NH4+;
(3)由卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子提供孤电子对,Mg2+提供空轨道,形成的化学键类型为配位键;5号C原子形成4个σ键和6号C原子形成3个σ键,一个π键,杂化方式分别为sp3、sp2;同一周期从左到右电负性增大,该分子中所含非金属元素的电负性由小到大的顺序为H<C<N<O。
故答案为:配位键;sp3、sp2;H<C<N<O;
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加德罗常数为NA,已知sin60°=![]() ),设晶胞的底边长为acm,高为hcm,由图知,晶胞中含4个C原子,石墨晶体的密度为ρ=
),设晶胞的底边长为acm,高为hcm,由图知,晶胞中含4个C原子,石墨晶体的密度为ρ=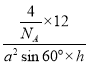 g·cm-3=
g·cm-3=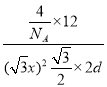 g·cm-3(列出计算式)。
g·cm-3(列出计算式)。
故答案为: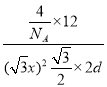 。
。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案