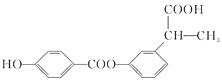
题目内容
【题目】现有浓度均为0.1 mol/L的下列溶液:①硫酸②醋酸③氢氧化钠④氯化铵,请回答下列问题:
(1)①②③④四种溶液中促进水的电离的物质是(填序号)。
(2)①②③④四种溶液中pH由大到小的顺序是(填序号)。
(3)将②和③等体积混合后,混合液中各离子浓度由大到小的顺序是。
(4)25℃时,将pH=13的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=12,则a:b=。
(5)将a mol/L的氨水溶液与①等体积混合后,溶液呈中性,则氨水的电离平衡常数Kb=。
【答案】
(1)④
(2)③>④>②>①
(3)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
(4)2:9
(5)![]() ×10-7。
×10-7。
【解析】(1)酸和碱抑制水的电离,能够时间段盐促进水的电离,促进水的电离的物质是氯化铵,故选④;
(2)①硫酸中c(H+)=0.2mol/L,②醋酸中c(H+)<0.1mol/L,③氢氧化钠中c(OH-)=0.1mol/L,④氯化铵水解,溶液显酸性, pH由大到小的顺序是③>④>②>①;
(3)将②和③等体积混合后恰好反应生成醋酸钠,醋酸钠水解溶液显碱性,溶液中各离子浓度由大到小的顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(4)pH=2的H2SO4溶液c(H+)=10-2mol/L,pH=13的NaOH溶液中c(OH-)=10-1mol/L,混合溶液中c(OH-)=10-2mol/L= ![]() =
= ![]() ,解得V(NaOH):V(H2SO4)=2:9;
,解得V(NaOH):V(H2SO4)=2:9;
(5)将a molL-1的氨水与1molL-1的硫酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,溶液中c(NH4+)=2c(SO42-)=2× ![]() mol/L=1mol/L,混合后反应前c(NH3H2O)=
mol/L=1mol/L,混合后反应前c(NH3H2O)= ![]() mol/L,则反应后c(NH3H2O)=(
mol/L,则反应后c(NH3H2O)=( ![]() -1)mol/L,则k=
-1)mol/L,则k= ![]() =
= ![]() ×10-7;
×10-7;
故答案为:(1)④;(2)③>④>②>①;(3)c(Na+)>c(CH3COO-)>c(OH-)>c(H+);(4)2:9;(5)![]()
(1)酸碱会抑制水的电离,可水解的盐会促进水的电离;
(2)对pH进行大小排序时,应先判断溶液的酸碱性,再结合水解、电离程度确定酸碱性的程度大小,进而确定pH的大小;
(3)混合后所得溶液的溶质为CH3COONa,根据电离、水解进行分析;
(4)计算酸碱混合后所得溶液的pH时,应注意混合溶液的体积约等于二者体积之和,结合c(H+)的计算公式进行计算即可;
(5)混合后所得溶液显中性,说明c(H+)=c(OH-)=1×10-7mol/L,根据电荷守恒计算c(NH4+),结合NH3·H2O平衡常数的计算表达式进行计算;

 名校课堂系列答案
名校课堂系列答案【题目】某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 | 实验装置 | 实验现象 |
1 |
| 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
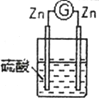
2 |
| 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
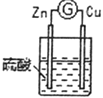
3 |
| 铜棒表面的现象是______________________,电流计指针___________________ |
①通过实验2和3,可得出原电池的形成条件是______________________________。
②通过实验1和3,可得出原电池的形成条件是______________________________。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________。
Cu棒:______________________________。
(3)实验3的电流是从________棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________g。