题目内容
【题目】短周期元素A、B、C、D,其有关性质或结构信息如表所示.
元素 | A | B | C | D |
有关性质或结构信息 | 能形成+7价的化合物 | 基态原子核外s能级上的电子数是p能级上的电子数的2倍 | 该元素形成的单质通常有两种同素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用 | 通常情况下能形成短周期中最稳定的双原分子分子 |
(1)B位于元素周期表中第周期第族,元素B和元素C相比,电负性较小的是(写元素名称).化合物BC2晶体与B的单质晶体属(填同一类型或不同类型).
(2)写出元素C的含有10个中子的一种核素符号 , B的一种氢化物B2H2分子中σ键与π键的数目之比为 .
(3)C与D可以组成多种形式的化合物.其中D2C5能勾水反应生成物质X.写出物质X的稀溶液与过景的Fe反应的离子方程式:
(4)A的最髙价氧化物为无色液体,9.15g该物质与足跫的水混合,得到一种稀溶液,并放出QKJ热量,该反应的热化学反应方程式为 .
【答案】
(1)二;ⅣA;碳;同一类型或不同类型
(2)818O;3:2
(3)3Fe+8H++2NO3﹣═3Fe2++2NO↑+4H2O
(4)Cl2O7(l)+H2O(l)=2HClO4(aq)△H=﹣20QKJ?mol﹣1
【解析】解:短周期元素A、B、C、D,A能形成+7价的化合物,则A为Cl;B基态原子核外s能级上的电子数是p能级上的电子数的2倍,则其原子核外电子排布为1s22s22p2 , 故B为碳元素;C元素形成的单质通常有两种同素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用,则C为O元素;通常情况下D元素能形成短周期中最稳定的双原分子分子,则D为N元素,(1)B为碳元素,位于元素周期表中第二周期第ⅣA族;同周期自左而右电负性增大,故电负性C<O;化合物CO2晶体属于原子晶体,碳的单质中金刚石为原子晶体、C60为分子晶体,故晶体类型为:同一类型或不同类型, 所以答案是:二;ⅣA;碳;同一类型或不同类型;(2)元素O的含有10个中子的一种核素符号为818O,碳的一种氢化物C2H2分子结构式为H﹣C≡C﹣H,分子中σ键与π键的数目之比为3:2,
所以答案是:818O;3:2;(3)N2O5与水反应生成物质X为HNO3 , 稀硝酸与过量的Fe反应生成硝酸亚铁、NO与水,反应离子方程式为:3Fe+8H++2NO3﹣═3Fe2++2NO↑+4H2O,
所以答案是:3Fe+8H++2NO3﹣═3Fe2++2NO↑+4H2O;(4)A的最髙价氧化物Cl2O7为无色液体,9.15gCl2O7的物质的量= ![]() =0.05mol,与水混合,得到稀HClO4溶液,并放出QkJ热量,则1molHClO4反应放出的热量=QkJ×
=0.05mol,与水混合,得到稀HClO4溶液,并放出QkJ热量,则1molHClO4反应放出的热量=QkJ× ![]() =20QkJ,故该反应的热化学反应方程式为:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=﹣20QKJmol﹣1 ,
=20QkJ,故该反应的热化学反应方程式为:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=﹣20QKJmol﹣1 ,
所以答案是:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=﹣20QKJmol﹣1 .

【题目】2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述不正确的是( )
A.比丁烷更易液化B.光照能够发生取代反应
C.分子中的碳原子不在一条直线上D.是石油分馏的一种产品
【题目】1000mL某待测液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣ |
现进行如下实验操作(所加试剂均过量):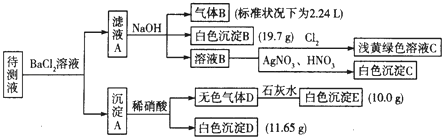
(1)写出生成白色沉淀B的离子方程式: .
(2)若无色气体D是单一气体: ①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
阴离子 | Cl﹣ | Br﹣ | CO32﹣ | HCO3﹣ | SO32﹣ | SO42﹣ |
浓度/molL﹣1 |
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由: .
(3)若无色气体D是混合气体,待测液中一定含有的阴离子是 .
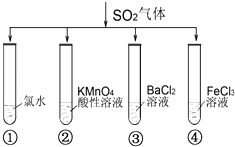
【题目】汽车尾气中二氧化硫、氮氧化物和可吸入颗粒物是雾霾主要组成.某课题组用汽车尾气为原料探究二氧化硫、氮氧化物的化学性质.
(1)I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化.写出一氧化碳与一氧化氮反应的化学方程式: Ⅱ.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答:
B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为;C中反应的离子方程式为 .
(2)为了实现绿色环保的目标,制取SO2装置最好选择 . (A1或A2装置)用氨水吸收尾气中的SO2 , “吸收液”中可能含有OH﹣、SO32﹣、SO42﹣、HSO3﹣等阴离子.请回答:
(3)氨水吸收过量SO2的反应的离子方程式为
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32﹣、HSO3﹣ , 完成下表的实验操作、预期现象和结论:
实验操作 | 预期现象与结论 |
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32﹣或 SO42﹣ . |
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 . |