题目内容
【题目】向含S2﹣、Fe2+、Br﹣、I﹣各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系图正确的是( )
A.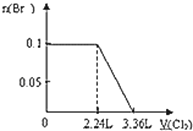 B.
B.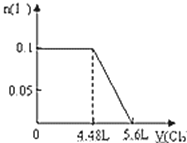
C.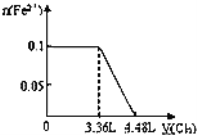 D.
D.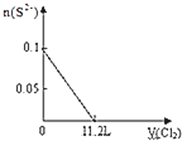
【答案】C
【解析】
离子还原性S2->I->Fe2+>Br-,故首先发生反应S2-+Cl2=S↓+2Cl-,再发生反应2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积。
A、Br-的物质的量与Cl2的体积的关系图,根据分析,S2-、I-、Fe2+完全被氧化的时候,Br-才被氧化。根据电荷守恒,S2-被氧化生成S,化合价升高2价,I-被氧化得到I2,化合价升高1价,Fe2+被氧化得到Fe3+化合价升高1价,则S2-、I-、Fe2+完全氧化时,转移的电子的物质的量为0.1×(2+1+1)=0.4mol,1molCl2得到2mol电子生成2molCl-,先得到0.4mol电子,则氯气体积为0.4mol÷2×22.4L/mol=4.48L,即溴离子开始反应时氯气的体积为4.48L,由2Br-+Cl2=Br2+2Cl-可以知道,0.1molBr-完全反应消耗0.05mol氯气,故溴离子完全反应时消耗氯气的体积为4.48L+ 0.05mol×22.4L/mol=5.6L,图象中氯气的体积不符合,故A错误;
B、I-的物质的量与Cl2的体积的关系图,0.1mol S2-完全反应后,才发生2I-+Cl2=I2+2Cl-,0.1mol S2-完全反应需要消耗0.1mol氯气,故开始反应时氯气的体积为2.24L,0.1mol I-完全反应消耗0.05mol氯气,故0.1mol I-完全反应时氯气的体积为0.15mol×22.4L/mol=3.36L,图象中氯气的体积不符合,故B错误;
C、Fe2+的物质的量与Cl2的体积的关系图,0.1mol S2-完全反应需要消耗0.1mol氯气,0.1molI-完全反应消耗0.05mol氯气,故亚铁离子开始反应时氯气的体积为0.15mol×22.4L/mol=3.36L,由2Fe2++Cl2=2Fe3++2Cl-可以知道,0.1mol Fe2+完全反应消耗0.05mol氯气,故Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,图象与实际符合,故C正确;
D、由S2-+Cl2=S+2Cl-,可以知道,0.1mol S2-完全反应需要消耗0.1mol氯气,标准状况下的Cl2的体积为0.1mol×22.4L/mol=2.24L,图象中氯气的体积不符合,故D错误;
综上所述,答案为C。

【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为_____.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL 蒸馏水,振荡,恢复至室温,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_____.
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
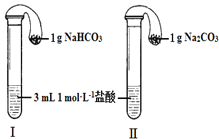
①两试管中均产生气体,_____(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是_____.
a 装置 I的气球体积较大 b 装置Ⅱ的气球体积较大
c 装置 I的气球体积等于装置Ⅱ的气球体积 d 无法判断
(4)同学们将两种固体分别配制成0.5molL﹣1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2mL Na2CO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应__________(写离子方程式). |
操作2:向2mL NaHCO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 无白色沉淀 | Na2CO3溶液中的CO32﹣浓度很小,不能与CaCl2发生反应。 |
操作1反应的离子方程式为________________,实施试验后,发现操作2的现象与预测有差异,产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为____________.