题目内容
【题目】下列说法正确的是
A.电解精炼铜时,若转移2NA个电子,则阳极减少的质量为64g
B.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
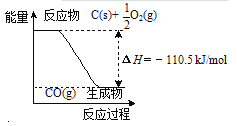
C.![]() 在常温下能自发进行,则该反应的△H>0
在常温下能自发进行,则该反应的△H>0
D.常温下,![]() 。欲使溶液中
。欲使溶液中![]() ,需调节溶液的
,需调节溶液的![]()
【答案】D
【解析】
A.阳极材料为粗铜,含有Fe、Zn等杂质,电解过程中Fe、Zn和Cu都要溶解,故转移2NA个电子时,阳极减少的质量不一定为64g,故A错误;
B.合成氨生产中将NH3液化分离,减小了生成物的浓度,平衡向反应正方向移动,提高了H2的转化率,由于浓度减小,反应速率减小,故B错误;
C.![]() ,该反应的△S<0,常温下能自发进行,说明△H-T△S<0,则△H<0,为放热反应,故C错误;
,该反应的△S<0,常温下能自发进行,说明△H-T△S<0,则△H<0,为放热反应,故C错误;
D.使溶液中c(Al3+)≤1×10-6 molL-1,c(OH-)≥![]() =10-9 molL-1,即调节溶液的pH≥5,故D正确;
=10-9 molL-1,即调节溶液的pH≥5,故D正确;
答案选D。

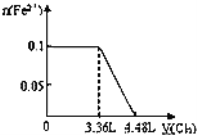
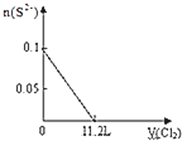
【题目】下列图示与文字叙述相符合的是
A | B |
|
|
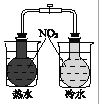
12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ | 热水浴的烧瓶中气体颜色较浅 |
C | D |
|
|
验证AgCl溶解度大于Ag2S | 钢闸门作为阴极而受到保护 |
A. AB. BC. CD. D
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、NH3、CO2为原料先制得NaHCO3,进而生产出纯碱。回答下列问题:
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)
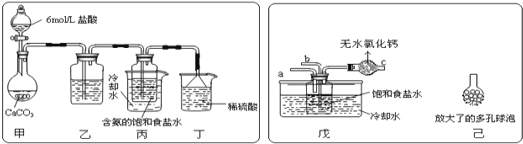
(1)丁装置中稀硫酸的作用是____。
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从___管通入NH3气体。
(3)有同学建议在戊装置的b管下端连接己装置,理由是_____。
(4)如表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水):
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:____。
(5)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为ag。再将晶体加热到质量不再变化时,称量所得粉末质量为mg。然后进行如图所示实验:
![]()
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是___(填字母)。
a 在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b 在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c 在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为___。
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|