题目内容
【题目】甲醇是制造燃料电池的重要原料,工业上用CH4和H2O为原料来制备甲醇。
(1)将2.0 molCH4和3.0molH2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如下图。

①已知压强为p1,100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为_________。
②图中的p1_______ p2(填“<”“>”或“=”),100℃时平衡常数为_______________。
③在其他条件不变的情况下降低温度,重新达到平衡时H2体积分数将________________(填“增大”“减小”或“不变”)
(2)在压强为0.1MPa条件下,将 amolCO与2 amolH2的混合气体在催化剂作用下能自发反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
①该反应的△H________0,△S_________0(填“<”“>”或“=”)
②若容器容积不变,下列措施可提高H2转化率的是__________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.再充入2 molCO和2molH2 D.充入He,使体系总压强增大
【答案】 0.0060mol·L-1·min-1 < 1.35×10-3 减小 < < BC
【解析】(1)①由图可知,100°C时达到平衡时甲烷的转化率为0.5,则转化的甲烷为0.5mol,求出△c(CH4),根据v=![]() ,计算v(CH4),利用速率之比等于化学计量数之比计算v(H2);②根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;平衡常数k=计算出平衡时各组分的浓度,代入平衡常数表达式计算;
,计算v(CH4),利用速率之比等于化学计量数之比计算v(H2);②根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;平衡常数k=计算出平衡时各组分的浓度,代入平衡常数表达式计算;
③降低温度,平衡右移.
(2)混合气体在催化剂作用下能自发反应生成甲醇,而正反应是气体物质的量减小的反应,则说明正反应是放热反应,据此解答。
(1)①由图可知, 100°C时达到平衡时甲烷的转化率为0.5,则转化的甲烷为0.5mol,速率之比等于化学计量数之比,则v(H2)=3v(CH4)=3×![]() =0.0060molL1min1
=0.0060molL1min1
②正反应为气体体积增大的反应,恒温条件下增大压强,化学平衡逆向移动,甲烷的转化率减小,所以P1<P2,
100℃时 CH4(g)+H2O(g)=CO(g)+3H2(g)
初始浓度:0.02 0.03 00
变化浓度:0.01 0.01 0.01 0.03
平衡浓度:0.01 0.02 0.010.03
100℃时平衡常数k=![]() =1.35×10-3 molL2
=1.35×10-3 molL2
③由图像可知,当温度越高时甲烷的转化率越大,说明该反应是吸热反应,降低温度平衡左移,重新达到平衡时H2体积分数将减小.答案为:①0.0060mol·L-1·min-1②<③1.35×10-3
(2)①混合气体在催化剂作用下能自发反应生成甲醇,则说明正反应是放热反应,所以△H<0;正反应是气体物质的量减小的反应,气体的物质的量越多,其熵越大,所以△S<0;②A.升高温度平衡左移,H2转化率减小,A错误;B.将CH3OH(g)从体系中分离出来,平衡右移H2转化率增大,B正确;C.再充入2molCO和2molH2,CO增大的程度大于H2增大的程度,平衡右移,H2转化率增大,C正确;D. 充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,H2的转化率不变,D错误;答案选BC;答案为:①<、<②BC

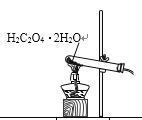
【题目】已知草酸晶体(H2C2O4·2H2O)的熔点为101℃,170℃分解。下列选用的装置和药品能达到实验目的的是
A | B | C | D |
|
|
|
|
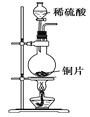
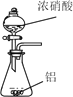
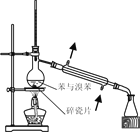
制取SO2 | 制取NO2 | H2C2O4·2H2O分解 | 分离苯与溴苯 |
A. A B. B C. C D. D