��Ŀ����
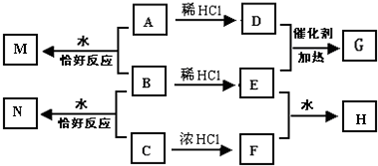 A��B��C��Ϊ�Ƶij���������ڿ�����¶�þ��ױ��ʣ���A�ı��ʹ����а������Ե���ɫ�仯����֪C��һ������������Ч�ɷ֣�D��FΪ�����������壬EΪ��Ҫ�Ĵ�����Ⱦ��֮һ��H��Һ��ǿ���ԣ�N��Һ�е���������H��Һ�е���ͬ�����ǿ��Է�����ͼ��ʾ�ķ�Ӧ��
A��B��C��Ϊ�Ƶij���������ڿ�����¶�þ��ױ��ʣ���A�ı��ʹ����а������Ե���ɫ�仯����֪C��һ������������Ч�ɷ֣�D��FΪ�����������壬EΪ��Ҫ�Ĵ�����Ⱦ��֮һ��H��Һ��ǿ���ԣ�N��Һ�е���������H��Һ�е���ͬ�����ǿ��Է�����ͼ��ʾ�ķ�Ӧ��������и��⣺
��1������A�ڿ�������ȫ���ʵ�ʵ�����������Ϊ
��2��B�ڿ����б��ʵĻ�ѧ����ʽΪ
��3��B��C��ˮ�з�Ӧ�����ӷ���ʽΪ
��4������H�����������ӵ�ʵ�鷽��
��1��AΪNa2O2����������Na2CO3����������ˮ���������ݲ�����˵���Ѿ���ȫ���ʣ�
�ʴ�Ϊ��ȡA����Ʒ�������Թ��У���������ˮ���������ݲ�����˵���Ѿ���ȫ���ʣ�
��2��BӦΪNa2SO3�����л�ԭ�ԣ���������������Ӧ����ѧ����ʽΪ2Na2SO3+O2=2Na2SO4���ʴ�Ϊ��2Na2SO3+O2=2Na2SO4��
��3��BӦΪNa2SO3��CΪNaClO�����߿ɷ���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪSO32-+ClO-=SO42-+Cl-������1molNaClO�μӷ�Ӧ������ת��Ϊ2NA��
�ʴ�Ϊ��SO32-+ClO-=SO42-+Cl-��2��
��4��H��N�ж�����SO42-��Cl-���ӣ�ȡH��Һ�������Թ��У���������Ba��NO3��2��Һ��������ɫ������˵������SO42-���ӣ����ã����ϲ���Һ�м�������AgNO3��Һ����������ɫ������˵������Cl-���ӣ�
�ʴ�Ϊ��ȡH��Һ�������Թ��У���������Ba��NO3��2��Һ��������ɫ������˵������SO42-���ӣ����ã����ϲ���Һ�м�������AgNO3��Һ����������ɫ������˵������Cl-���ӣ�

 ������������ϵ�д�
������������ϵ�д�| A������5%̼��������ҺΪijЩ���ж����߽�����Һ���� | B��ͭ�Ľ��������Ա������������ں����������������ͭ���Լ����丯ʴ | C���ϳɰ��ķ�Ӧ�Ƿ��ȷ�Ӧ����˹�ҵ�ϳɳ����õ������� | D����Ũ�Ⱦ�Ϊ0.01 mol/L NaCl��Na2CrO4����Һ�еμ�0.01 mol/L AgNO3��Һ��������AgCl����Ksp��AgCl����Ksp��Ag2CrO4�� |
����̼ѭ��������������ҵĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����Ϊ��ѧ���о�����Ҫ���⡣
��1���õ绡���ϳɵĴ�������̼�ܳ����д�����̼�����������ʣ������ֿ������������������ᴿ������ɸ÷�Ӧ�Ļ�ѧ����ʽ��
___ C+ ___ KMnO4+ ____ H2SO4��____CO2��+ ____MnSO4 + ____K2SO4+ ____H2O
��2������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g) CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
|
ʵ���� |
�¶ȡ� |
��ʼ��/mol |
ƽ����/mol |
�ﵽƽ������ ʱ��/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1��6 |
2��4 |
6 |
|
2 |
900 |
2 |
1 |
0��4 |
1��6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
��ʵ��2������ƽ�ⳣ��K= ��
��ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ��������a/b ��ֵ______(�����ֵ��ȡֵ��Χ)��
��ʵ��4����900��ʱ���ڴ������м���CO��H2O��CO2 ��H2��Ϊ1mol�����ʱV�� V�����<�� ����>�� ����=������
��3����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H����1275.6 kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H����566.0 kJ��mol
�� H2O(g) �� H2O(l) ��H����44.0 kJ��mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��____________
��4����֪������һ�ֶ�Ԫ���ᣬ�������ƣ�NaHC2O4����Һ�����ԡ������£���10 mL 0.01 mol��L-1 H2C2O4��Һ�еμ�10mL 0.01mol��L-1 NaOH��Һʱ���Ƚ���Һ�и�������Ũ�ȵĴ�С��ϵ ��
��5��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10-9��
CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ1��10-4mo1/L �������ɳ�������CaCl2��Һ����СŨ��Ϊ mo1/L ��
��ͼΪũ��ɽȪ��Ȫˮƿ�ϵIJ���˵�����֣��г��˸�������Ȼˮ����ָ�ꡣ����ĸơ�þ���ء�����ָ
|
������Ȼˮ����ָ�� ����Ԫ�� �ⶨ��� �ơ�4.0 mg/L þ��0.5 mg/L �ء�0.35 mg/L �ơ�0.8 mg/L ƫ�����1.8 mg/L pH (25��) 7.1
���𰸡�D ���������� �����͡�ѡ���� �����á����� �����⡿2010��������һ�и�һ��ѧ�����п��Ի�ѧ�Ծ� ���ؼ��ֱ�ǩ��ũ��ɽȪ��ָ�� �������� 3�����ġ�����ʵ������У��������
���𰸡�D ���������� �����͡�ѡ���� �����á����� �����⡿2010��������һ�и�һ��ѧ�����п��Ի�ѧ�Ծ� ���ؼ��ֱ�ǩ��ʵ����� �������� 4�����ġ�����˵������ȷ����
���𰸡�B ���������� �����͡�ѡ���� �����á����� �����⡿2010��������һ�и�һ��ѧ�����п��Ի�ѧ�Ծ� ���ؼ��ֱ�ǩ����������ԭ���� �������� 5�����ġ������й�0.2mol��L��1 BaCl2��Һ��˵������ȷ����
���𰸡�A ���������� �����͡�ѡ���� �����á����� �����⡿2010��������һ�и�һ��ѧ�����п��Ի�ѧ�Ծ� ���ؼ��ֱ�ǩ����Һ������Ũ�� �������� 6�����ġ��������ӷ���ʽ����д��ȷ����(����)
���𰸡�B ���������� �����͡�ѡ���� �����á����� �����⡿2010��������һ�и�һ��ѧ�����п��Ի�ѧ�Ծ� ���ؼ��ֱ�ǩ�����ӷ���ʽ���������� �������� 7�����ġ���֪�����·�Ӧ����2Fe3����2I��===2Fe2����I2 ��2Fe2����Br2===2Fe3����2Br�� ��2Fe(CN)��I2===2Fe(CN)��2I�������ж�������ǿ��˳����ȷ����
���𰸡�C ���������� �����͡�ѡ���� �����á����� �����⡿2010��������һ�и�һ��ѧ�����п��Ի�ѧ�Ծ� ���ؼ��ֱ�ǩ�������ԣ�˳�� �������� 8�����ġ�ʵ������ȡ����N2�����õķ�Ӧ��NaNO2��NH4ClNaCl��N2����2H2O�����ڸ÷�Ӧ��˵����ȷ����
���𰸡�A ���������� �����͡�ѡ���� �����á����� �����⡿2010��������һ�и�һ��ѧ�����п��Ի�ѧ�Ծ� ���ؼ��ֱ�ǩ��ʵ���ң������� �������� 9�����ġ���������ƽ������������ʱ��������Ʒ��������������ϵ�λ�õߵ���ƽ��ʱ�����ϵ���������Ϊ10g������Ϊ0.5g������Ʒ������Ϊ
���𰸡�D ���������� �����͡�ѡ���� �����á����� �����⡿2010��������һ�и�һ��ѧ�����п��Ի�ѧ�Ծ� ���ؼ��ֱ�ǩ��������ƽ������ �������� 10�����ġ���26�˺���SiO2��CaCO3�����ڸ����¼������������ٸı䣬��ȴ�����Ϊ17.2�ˡ�����֪��SiO2 + CaCO3 CaSiO3 + CO2����SiO2��CaSiO3��Ϊ���壩 ��1�������ɵ�CO2���������״���£� ��2����ԭ�����������SiO2�������� ���𰸡���1��4.48L ��2��6�� ���������� �����͡������� �����á����� �����⡿2010��������һ�и�һ��ѧ�����п��Ի�ѧ�Ծ� ���ؼ��ֱ�ǩ�����£���� �������� |