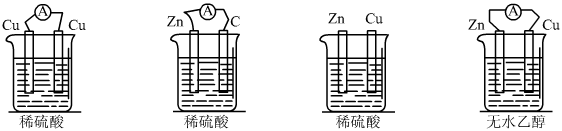
题目内容
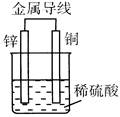
铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①实验过程中取出盐桥,原电池仍继续工作
②将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
③负极反应为:Ag+ + e- = Ag
④盐桥内的K+移向AgNO3溶液
①实验过程中取出盐桥,原电池仍继续工作
②将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
③负极反应为:Ag+ + e- = Ag
④盐桥内的K+移向AgNO3溶液
| A.②④ | B.①② | C.②③ | D.③④ |
A
试题分析:将铜片插入硝酸铜溶液中、银片插入硝酸银溶液中,铜片与银片用导线连接,两烧杯之间用盐桥连接构成原电池。若取出盐桥,则形成断路,不能构成原电池,①错误;该电池总反应为Cu+2AgNO3=Cu(NO3)2+2Ag,与铜片浸入硝酸银溶液中发生的化学反应相同,②正确;负极为Cu,电极反应式为Cu-2e-=Cu2+、正极为Ag,电极反应式为Ag++e-=Ag,③错误;盐桥中阳离子向正极迁移、阴离子向负极迁移,④正确。
点评:原电池中负极失去电子,发生氧化反应;正极表面得到电子,发生还原反应。电子由负极经导线流向正极,原电池内部,阳离子向正极迁移、阴离子向负极迁移。

练习册系列答案
相关题目