题目内容
| |||||||||||||||||||||||||||||||||||
解析:
(1) |
碱性,B2-+H2O |
(3) |
<,H2B第一步电离产生的H+,抑制了HB-的电离 |
(4) |
c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-) |

(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量 浓度(mol·L-1) | NaOH的物质的量 浓度(mol·L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A— )和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
![]()
![]()
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2— )+c(HB— )=0.1mol/L B.c( B2— )+ c(HB— )+c(H2B)=0.1mol/L
C c(OH— )=c(H+)+ c(HB— ) D.c(Na+)+c(OH)=c(H+)+ c(HB— )
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量 浓度(mol·L-1) | NaOH的物质的量 浓度(mol·L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A— )和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
![]()
![]()
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2— )+c(HB— )=0.1mol/L B.c( B2— )+ c(HB— )+c(H2B)=0.1mol/L
C c(OH— )=c(H+)+ c(HB— ) D.c(Na+)+c(OH)=c(H+)+ c(HB— )
 H++A2-回答下列问题:
H++A2-回答下列问题: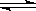 H+ +
A2- 回答下列问题:
H+ +
A2- 回答下列问题: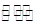 H++A2-回答下列问题:
H++A2-回答下列问题: