题目内容
8.如图1所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.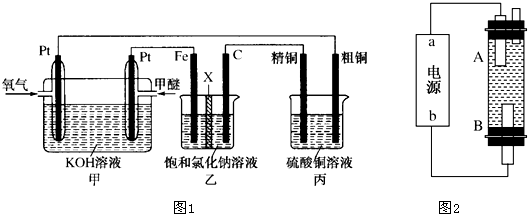
根据要求回答相关问题:
(1)通入氧气的电极为正极(填“正极”或“负极”),其电极反式:O2+2H2O+4e-═4OH-.
(2)铁电极为阴极(填“阳极”或“阴极”),石墨电极(C)的电极反应式为2Cl--2e-═Cl2↑.
(3)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为Zn-2e-=Zn2+、Cu-2e-=Cu2+.反应一段时间,硫酸铜溶液浓度将减小(填“增大”、“减小”或“不变”).
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为0.2×6.02×1023;丙装置中阴极析出铜的质量为12.8g.
(5)某同学利用甲醚燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图2所示).
①若用于制漂白液,a为电池的负极(填“正极”或“负极”),电解质溶液最好用饱和食盐水.
②若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用铁作电极.
分析 (1)燃料电池是将化学能转变为电能的装置,属于原电池,投放燃料的电极是负极,负极上燃料失电子发生氧化反应,投放氧化剂的电极是正极,正极上氧化剂得电子发生还原反应;
(2)电解饱和氯化钠溶液时,连接原电池负极的电极是阴极,连接原电池正极的电极是阳极,阳极上氯离子放电,阴极上氢离子放电,注意如果活泼电极作阳极,则阳极上电极材料放电而不是溶液中阴离子放电;
(3)粗铜精炼时,粗铜作阳极,阳极上金属失电子,阴极上铜离子得电子,根据阴阳极上金属的变化确定溶液中铜离子是否变化;
(4)串联电池中转移电子数相等,根据转移电子数相等计算乙装置中铁电极上生成的气体的分子数及丙装置中阴极析出铜的质量;
(5)①电解饱和食盐水时,阴极上析出氢气,阳极上析出氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠是漂白液的有效成分;
②若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阴极上氢离子放电生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧化钠反应生成氢氧化亚铁.
解答 解:(1)燃料电池是将化学能转变为电能的装置,属于原电池,投放燃料的电极是负极,投放氧化剂的电极是正极,所以通入氧气的电极是正极,电极反应式为:O2+2H2O+4e-═4OH-;故答案为:正极,O2+2H2O+4e-═4OH-;
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑;
故答案为:阴极;2Cl--2e-═Cl2↑;
(3)如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌失电子进入溶液,反应式为:Zn-2e-=Zn2+、Cu-2e-=Cu2+,阴极上析出铜,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小;
故答案为:Zn-2e-=Zn2+、Cu-2e-=Cu2+;减小;
(4)根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2----2H2----2Cu,设生成氢气的分子数是x,生成铜的质量是y.
O2-------2H2-------2Cu
22.4L 26.02×1023 128g
2.24L x y
x=0.2×6.02×1023
y=12.8g
故答案为:0.2×6.02×1023,12.8 g;
(5)①电解饱和食盐水时,阴极上析出氢气,阳极上析出氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠是漂白液的有效成分,B电极上生成氯气,氯气的密度小于溶液的密度,所以生成的氯气上升,能和氢氧化钠溶液充分的接反应生成次氯酸钠,所以A极上析出氢气,即A极是阴极,所以a为电池负极;故答案为:负极;饱和食盐水;
②若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阴极上氢离子放电生成氢气,如果阳极是惰性电极,阳极上氢氧根离子放电生成氧气得不到氢氧化亚铁,所以阳极上应该是铁失电子生成亚铁离子,亚铁离子和氢氧化钠反应生成氢氧化亚铁.
故答案为:铁.
点评 本题以原电池和电解池原理为载体考查了电极反应式的书写、物质的量的有关计算等知识点,注意燃料电池中电极反应式的书写要结合电解质溶液的酸碱性,燃料相同,如果电解质溶液不同,电极反应式则不同,为易错点.

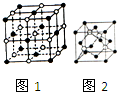 钠和铜的单质及其化合物在生活实际中有着广泛的应用.
钠和铜的单质及其化合物在生活实际中有着广泛的应用.(1)Cu2+基态的核外电子排布式为1s22s22p63s23p63d9;
(2)NaCl晶体的晶胞结构如图1所示,在NaCl的晶胞中含有的阴离子的个数为4,阳离子的配位数为6;
(3)钠的有关卤化物的熔点间下表,钠的卤化物熔点按NaF、NaCL、NaBr、NaI顺序降低的原因是氟离子、氯离子、溴离子、碘离子的半径变小,所以NaF、NaCL、NaBr、NaI晶体的晶格能变小,所以熔点降低;
| NaF | NaCl | NaBr | NaI | |
| 熔点/℃ | 993 | 801 | 747 | 661 |
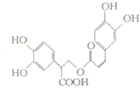 迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )
迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )| A. | 7:6:1 | B. | 7:6:5 | C. | 6:7:1 | D. | 6:7:5 |
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),前者放出的热量多 | |
| D. | 在101 kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
| A. | 氨水 | B. | SO2 | C. | CH3COOH | D. | BaSO4 |
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | “酸可除锈”、“洗涤剂可去油”都是发生了化学变化 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 油脂有油和脂肪之分,在酸性条件下水解生成高级脂肪酸和甘油 |
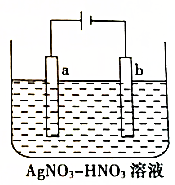 如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.
如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.