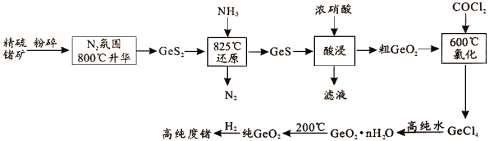
题目内容
【题目】按要求回答下列问题:
(1)用氧化物的形式表示硅酸盐的组成,钙沸石Ca(Al2Si3O10)·3H2O表示为___。
(2)氢氟酸可刻蚀玻璃,反应的化学方程式为___。
(3)工业上使用漂白粉时常向其中加入稀盐酸,化学方程式为___。
(4)将钠、镁、铝各0.4mol分别放入100mL1mol/L的盐酸中,同温同压下产生的气体体积比为___。
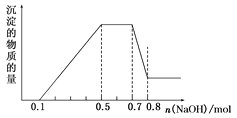
(5)向20mL含有1mol/L的氯化铝和一定量盐酸的溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的质量与所加碱的体积如图所示,若由于碱过量,最终产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积是___mL。
(6)将物质的量之比为2:3:4的N2、O2、CO2混合气体通过一定量Na2O2后,气体体积变为原体积的![]() (同温同压),这时混合气体中N2、O2、CO2物质的量之比为___。
(同温同压),这时混合气体中N2、O2、CO2物质的量之比为___。
【答案】CaO·Al2O3·3SiO2·3H2O SiO2+4HF=SiF4↑+2H2O Ca(ClO)2+2HCl=CaCl2+2HClO 4:1:1 90 1:2:1
【解析】
(1)将硅酸盐改写为氧化物形式即可,注意金属氧化物在前,二氧化硅在后,水在最后;
(2)写出氟化氢和二氧化硅的反应即可;
(3)盐酸是强酸,通过强酸来制弱酸(次氯酸);
(4)要注意谁过量的问题,酸过量和金属过量的时候是不一样的,谁少按谁算;
(5)根据![]() 不难得出0.78g沉淀即0.01mol
不难得出0.78g沉淀即0.01mol![]() ,据此来分析即可;
,据此来分析即可;
(6)三者中只有![]() 和
和![]() 会反应,据此来分析即可。
会反应,据此来分析即可。
(1)钙沸石写成氧化物的形式为![]() ;
;
(2)二者的反应方程式为![]() ;
;
(3)盐酸制次氯酸的方程式为![]() ;
;
(4)首先根据![]() 算出盐酸的物质的量为0.1mol,而金属的量为0.4mol,金属明显过量,所以三者能产生的氢气是一样多的(盐酸中的氢元素就0.1mol这么多,能产生的氢气的量只能是0.05mol,羊毛出在羊身上),钠较活泼可以与水反应产生氢气,钠完全转变为
算出盐酸的物质的量为0.1mol,而金属的量为0.4mol,金属明显过量,所以三者能产生的氢气是一样多的(盐酸中的氢元素就0.1mol这么多,能产生的氢气的量只能是0.05mol,羊毛出在羊身上),钠较活泼可以与水反应产生氢气,钠完全转变为![]() ,0.4mol钠一共可以失0.4mol电子,每生成1mol氢气需要得2mol电子,则一共可以得到0.2mol氢气,因此钠、镁、铝能产生的氢气的量分别为0.2mol、0.05mol、0.05mol,三者的体积比为4:1:1;
,0.4mol钠一共可以失0.4mol电子,每生成1mol氢气需要得2mol电子,则一共可以得到0.2mol氢气,因此钠、镁、铝能产生的氢气的量分别为0.2mol、0.05mol、0.05mol,三者的体积比为4:1:1;
(5)当加入BmL碱时沉淀量最大,为![]() ,但是到100mL时沉淀全部溶解,因此若要剩余0.01mol
,但是到100mL时沉淀全部溶解,因此若要剩余0.01mol![]() ,根据
,根据![]() 可知只要少加0.01mol的碱即可,碱液浓度已知,根据
可知只要少加0.01mol的碱即可,碱液浓度已知,根据![]() 算出少加的体积,则加入的碱液体积为90mL;
算出少加的体积,则加入的碱液体积为90mL;
(6)根据![]() ,每2份
,每2份![]() 参加反应可以得到1份
参加反应可以得到1份![]() ,气体分子数减少1份,而反应后气体体积变为原体积的
,气体分子数减少1份,而反应后气体体积变为原体积的![]() ,不难看出只有2份
,不难看出只有2份![]() 参加了反应,因此反应后三者的物质的量之比为
参加了反应,因此反应后三者的物质的量之比为![]() 。
。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案【题目】青蒿素是一种高效的抗疟药,某研究性学习小组的同学通过查阅资料获得如下信息:青蒿素是由碳、氢、氧三种元素所组成的,熔点为156~157℃,他们设计了如下装置来测量青蒿素的分子组成,回答下列问题:
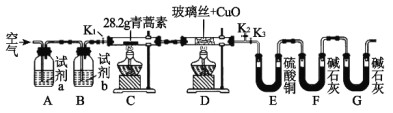
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
(1)试剂加入后首先要进行的操作是_____________,其目的是____________,实验中需要对开关K1、K2、K3进行操作,首次对开关K1、K2、K3进行操作的方法是________,适当时间后再关闭相应的开关,为提高实验的准确性,在C处停止加热后还应进行的操作是____________。
(2)试剂a、b分别是________________________________________,点燃C、D处酒精灯的先后顺序是___________________________,使用装置D的目的是___________。
(3)E中使用硫酸铜相对于使用CaCl2的好处(不考虑吸收效果的差异性)是_____。
(4)充分反应后获得的有关数据如上表(假设生成的气体全部被吸收):则测得青蒿素的最简式是_________________________。
(5)若要求出青蒿素的分子式,还需要通过实验测量出一个数据,请你指出该数据是什么,测量出该数据的方法是(只考虑理论上的可能性):___________。
【题目】(1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=___________kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________(用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________,O2的转化率为___________(用百分数表示,且保留小数点后一位),该反应的平衡常数为___________(列出计算式即可)。
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________

(3)下列有关该反应的说法正确的是___________(填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)