题目内容
【题目】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
Ⅰ.丙烷(C3H8)是一种优良的燃料,下图是一定量丙烷完全燃烧生成CO2和1molH2O(I)过程中的能量变化图。试回答下列问题:

(1)写出丙烷燃烧的热化学方程式:__________。
(2)二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ的热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ的热量,则混合气体中丙烷和二甲醚的物质的量之比为__________。
Ⅱ.用下图所示的装置进行中和热的测定实验,分别取50mL0.55mol/L的NaOH溶液、50mL0.25mol/L的硫酸进行实验,回答下列问题:
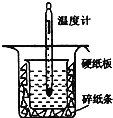
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是__________。
(2)近似认为0.55mol/L的NaOH溶液和0.25mol/L的硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃),通过以下数据计算中和热△H=__________(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)若改用60mL0.25mol/L的H2SO4和50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”)。 所求中和热___(填“等”或“不相等”),简述理由__________________________________________。
(4)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.将以上四实验测量温度均纳入计算平均值
【答案】C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2215.0kJ/mol1∶3环形玻璃棒未将小烧杯和大烧杯杯口保持相平-56.8kJ/mol不相等相等中和热是指酸跟碱发生中和反应生成1 mol H2O时所放出的热量,与酸碱的用量无关abc
【解析】
Ⅰ.(1)根据图象可知生成1mol液态水放出的热量是553.75kJ,则1mol丙烷完全燃烧生成4mol水放出的热量是![]() ,因此丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2215.0kJ/mol;
,因此丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2215.0kJ/mol;
(2)设混合气体中丙烷和二甲醚的物质的量分别是xmol、ymol,则x+y=1,1455y+2215x=1645kJ,解得x=0.25、y=0.75,因此混合气体中丙烷和二甲醚的物质的量之比为1:3;
Ⅱ.(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;为了减少热量的损失,大烧杯杯口与小烧杯杯口应该相平、小烧杯口用硬纸板盖住;
(2)第一次测定温度差为:(29.5-26.1)℃=3.4℃;第二测定温度差为:(32.3-27.2)℃=5.1℃;第三次测定温度差为:(29.2-25.9)℃=3.3℃;第四次测定温度差为:(29.8-26.3)℃=3.5℃;其中第二次的温度差误差较大,应该舍弃,其他三次温度差的平均值为:![]() 。50mL0.55mol/L的NaOH溶液与50mL0.25mol/L的硫酸进行中和反应,生成水的物质的量为0.05L
。50mL0.55mol/L的NaOH溶液与50mL0.25mol/L的硫酸进行中和反应,生成水的物质的量为0.05L![]() 0.50mol/L=0.025mol,溶液的质量为100mL
0.50mol/L=0.025mol,溶液的质量为100mL![]() 1g/mL=100g,温度变化的值为
1g/mL=100g,温度变化的值为![]() ,则生成0.025mol水放出的热量为Q=mc
,则生成0.025mol水放出的热量为Q=mc![]() =100g
=100g![]() 4.18J/(g
4.18J/(g![]() )=1421.2J,即1.4212kJ,所以实验测得的中和热
)=1421.2J,即1.4212kJ,所以实验测得的中和热![]() ;
;
(3)反应放出的热量和所用酸以及碱的量的多少有关,若改用60mL0.25mol/L的H2SO4和50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量增加,因此与上术实验相比,所放出的热量不相等;改变酸和碱的用量,反应中放出的热量会变化,但反应热是不变的,因为中和热是指酸跟碱发生中和反应生成1 mol H2O时所放出的热量,与酸碱的用量无关。故答案为相等;中和热是指酸跟碱发生中和反应生成1 mol H2O时所放出的热量,与酸碱的用量无关;
(4)a.实验装置保温、隔热效果必须好,否则放出的热量偏小,故正确;b.用温度计测定NaOH溶液起始温度后,要将温度计回零后再测定H2SO4溶液的温度,否则放出的热量偏小,故正确;c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把把NaOH溶液倒入盛有硫酸的小烧杯中,否则会导致较多热量散失,放出的热量偏小,故正确;d.根据以上分析可知将以上四实验测量温度均纳入计算平均值会导致反应放出的热量偏多,故错误。答案选abc。

【题目】关于强弱电解质及非电解质的组合完全正确的是( )
选项 | ① | ② | ③ | ④ |
强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
弱电解质 | HF | BaSO4 | HClO | CH3COOH |
非电解质 | Cl2 | CS2 | 蔗糖 | H2CO3 |
A.①B.②C.③D.④



