题目内容
(12分)短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13。已知B元素形成的化合物种类最多,D元素原子最外层电子数是次外层电子数的3倍,元素E的原子半径在同周期中最大,F元素原子最外层电子数等于其电子层数。
(1)C元素在元素周期表中的位置是_____________________,B的单质与C的最高价氧化物对应水化物的浓溶液发生反应的化学方程式是_________________
(2)由A、B、D、E四种元素形成的化合物中所含的化学键类型是_______________
(3)写出E2D2与A2D反应的离子方程式_____________________________________。
(4)实验室配制100mL0.2mol·L—1由A、D、E形成化合物的溶液,需要用到的玻璃仪器除烧杯、量筒外还有_________________________;如果定容时仰视刻度线,则所配制溶液浓度______________0.2mol·L—1(埴“>”、“<”或“=”)。将F的单质溶于上述配制的溶液中所发生反应的离子方程式是___________________________________
(1)C元素在元素周期表中的位置是_____________________,B的单质与C的最高价氧化物对应水化物的浓溶液发生反应的化学方程式是_________________
(2)由A、B、D、E四种元素形成的化合物中所含的化学键类型是_______________
(3)写出E2D2与A2D反应的离子方程式_____________________________________。
(4)实验室配制100mL0.2mol·L—1由A、D、E形成化合物的溶液,需要用到的玻璃仪器除烧杯、量筒外还有_________________________;如果定容时仰视刻度线,则所配制溶液浓度______________0.2mol·L—1(埴“>”、“<”或“=”)。将F的单质溶于上述配制的溶液中所发生反应的离子方程式是___________________________________
(1)第二周期第VA族 C+4HNO3(浓)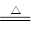 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)离子键、共价键
(3)2Na2O2+2H2O=4OH-+4Na++O2↑
(4)玻璃棒、100ml容量瓶、胶头滴管 < 2Al+2OH-+2H2O=2AlO2-+3H2↑
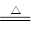 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O(2)离子键、共价键
(3)2Na2O2+2H2O=4OH-+4Na++O2↑
(4)玻璃棒、100ml容量瓶、胶头滴管 < 2Al+2OH-+2H2O=2AlO2-+3H2↑
B元素形成的化合物种类最多,即B为碳元素,进而可猜测A为氢元素;
D元素原子最外层电子数是次外层电子数的3倍,则其电子排布为2、6,即氧元素;进而可知C只能为氮元素;
元素E的原子半径在同周期中最大,可知它为第三周期的钠元素;F元素原子最外层电子数等于其电子层数,则其为第三周期的铝元素,核外电子排布为2、8、3;
综合各项信息以上推测完全正确
(1)氮元素位于元素周期表:第二周期第VA族
碳单质与浓硝酸的反应方程式为:C+4HNO3(浓)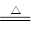 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)由A、B、D、E四种元素形成的化合物NaHCO3,其中含有离子键及共价键
(3)2Na2O2+2H2O=4OH-+4Na++O2↑
(4)配制NaOH溶液,需要用到的玻璃仪器包括烧杯、量筒、玻璃棒、100ml容量瓶及胶头滴管等;
如果定容时仰视刻度线,将导致加水偏多,所配制溶液浓度偏小
铝与NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑
D元素原子最外层电子数是次外层电子数的3倍,则其电子排布为2、6,即氧元素;进而可知C只能为氮元素;
元素E的原子半径在同周期中最大,可知它为第三周期的钠元素;F元素原子最外层电子数等于其电子层数,则其为第三周期的铝元素,核外电子排布为2、8、3;
综合各项信息以上推测完全正确
(1)氮元素位于元素周期表:第二周期第VA族
碳单质与浓硝酸的反应方程式为:C+4HNO3(浓)
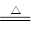 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O(2)由A、B、D、E四种元素形成的化合物NaHCO3,其中含有离子键及共价键
(3)2Na2O2+2H2O=4OH-+4Na++O2↑
(4)配制NaOH溶液,需要用到的玻璃仪器包括烧杯、量筒、玻璃棒、100ml容量瓶及胶头滴管等;
如果定容时仰视刻度线,将导致加水偏多,所配制溶液浓度偏小
铝与NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑

练习册系列答案
相关题目